题目内容
【题目】某化学研究性学习小组为了制取焦亚硫酸钠(![]() ),并对其性质进行研究。特进行如下实验:
),并对其性质进行研究。特进行如下实验:
实验一 制取焦亚硫酸钠。
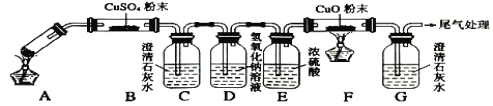
研究小组采用下图装置(实验前已除尽装置内的空气)制取![]() 。装置Ⅱ中有
。装置Ⅱ中有![]() 晶体析出,发生的反应为:
晶体析出,发生的反应为:![]() 。
。
(1)装置Ⅰ中通常采用70%~80%的浓硫酸与亚硫酸钠固体反应制取![]() ,而不用98%的浓硫酸或极稀的稀硫酸,原因是________________________。
,而不用98%的浓硫酸或极稀的稀硫酸,原因是________________________。
(2)若要从装置Ⅱ中获得已析出的晶体,所采取的分离方法需用到的玻璃仪器有________。
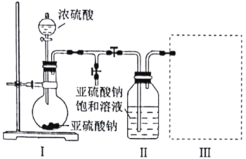
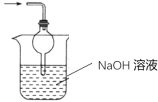
(3)装置Ⅲ用于处理尾气,请画出用来处理尾气并防止发生倒吸的实验装置,注明相应的试剂。
____________________________________________________________
(4)已知![]() 溶于水后,立即生成
溶于水后,立即生成![]() ,该反应的离子方程式为________________________。
,该反应的离子方程式为________________________。
(5)用![]() 试纸测得
试纸测得![]() 溶液呈酸性,其溶液呈酸性的原因是________________________。
溶液呈酸性,其溶液呈酸性的原因是________________________。
(6)取少量焦亚硫酸钠晶体于试管中,其中滴加酸性![]() 溶液,剧烈反应,溶液紫红色很快褪去,经测定溶液中产生
溶液,剧烈反应,溶液紫红色很快褪去,经测定溶液中产生![]() ,该反应的离子方程式是________________________。
,该反应的离子方程式是________________________。
实验三 焦亚硫酸钠的含量测定。
测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。
已知:![]() ;
;![]() 。
。
①精确称取干燥的产品![]() 放入碘量瓶(带磨口塞的锥形瓶)中。
放入碘量瓶(带磨口塞的锥形瓶)中。
②向碘量瓶中准确移取![]() ,
,![]() 的标准碘溶液(过量),振荡,使其与产品中的焦亚硫酸钠充分反应。
的标准碘溶液(过量),振荡,使其与产品中的焦亚硫酸钠充分反应。
③加入![]() 淀粉溶液,用标准
淀粉溶液,用标准![]() 溶液滴定至接近终点,重复操作3次,经计算得消耗标准液平均体积为
溶液滴定至接近终点,重复操作3次,经计算得消耗标准液平均体积为![]() 。
。
(7)上述实验操作滴定终点的现象为________________________;根据上述实验,计算产品中焦亚硫酸钠的质量分数为________________________。
【答案】98%的浓硫酸以分子存在,不能提供![]() ,浓度极稀的稀硫酸会使反应产生的
,浓度极稀的稀硫酸会使反应产生的![]() 部分溶解在其中,造成损耗 烧杯、漏斗、玻璃棒
部分溶解在其中,造成损耗 烧杯、漏斗、玻璃棒 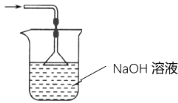
![]()
![]() 的电离程度大于水解程度
的电离程度大于水解程度 ![]() 当滴入最后一滴
当滴入最后一滴![]() 溶液时,溶液由蓝色变为无色,且半分钟内不恢复 76%
溶液时,溶液由蓝色变为无色,且半分钟内不恢复 76%
【解析】
(1)98%的浓硫酸中硫酸主要以分子形式存在,氢离子浓度小,反应速率慢,二氧化硫易溶于水,硫酸浓度过小,不利于二氧化硫逸出;
(2)过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)二氧化硫有毒会污染环境,装置Ⅲ为尾气处理装置,用氢氧化钠溶液吸收未反应的二氧化硫,同时用倒置的漏斗或干燥管防止产生倒吸;
(4)由题意可知Na2S2O5溶于水后,立即生成NaHSO3;
(5)用![]() 试纸测得NaHSO3溶液呈酸性,说明溶液中HSO3-的电离程度大于水解程度;
试纸测得NaHSO3溶液呈酸性,说明溶液中HSO3-的电离程度大于水解程度;
(6)焦亚硫酸钠与酸性高锰酸钾溶液发生氧化还原反应生成硫酸钠、硫酸锰和水;
(7)滴硫代硫酸钠溶液过量时溶液由蓝色变为无色;依据化学方程式计算可得。
(1)装置Ⅰ中亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,98%的浓硫酸中硫酸主要以分子形式存在,氢离子浓度小,反应速率慢,二氧化硫易溶于水,硫酸浓度过小,不利于二氧化硫逸出,故答案为:98%的浓硫酸以分子存在,不能提供H+,浓度极稀的稀硫酸会使反应产生的SO2部分溶解在其中,造成损耗;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态应采取过滤方法进行分离,过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:烧杯、漏斗、玻璃棒;
(3)二氧化硫有毒会污染环境,装置Ⅲ为尾气处理装置,用氢氧化钠溶液吸收未反应的二氧化硫,同时用倒置的漏斗或干燥管防止产生倒吸,实验装置为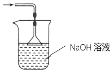 或
或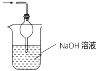 ,故答案为:
,故答案为: 或
或 ;
;
(4)由题意可知Na2S2O5溶于水后,立即生成NaHSO3,反应的离子方程式为S2O52—+ H2O=2 HSO3—,故答案为:S2O52—+ H2O=2 HSO3—;
(5)用![]() 试纸测得NaHSO3溶液呈酸性,说明溶液中HSO3-的电离程度大于水解程度,故答案为:HSO3-的电离程度大于水解程度;
试纸测得NaHSO3溶液呈酸性,说明溶液中HSO3-的电离程度大于水解程度,故答案为:HSO3-的电离程度大于水解程度;
(6)由题意可知,焦亚硫酸钠与酸性高锰酸钾溶液发生氧化还原反应生成硫酸钠、硫酸锰和水,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(7)由题意可知,当滴入最后一滴硫代硫酸钠溶液时,溶液由蓝色变为无色,且半分钟内不恢复说明达到滴定终点;由方程式可得2n(S2O52—)+![]() (S2O32-)=2(I2),n(S2O52—)=
(S2O32-)=2(I2),n(S2O52—)=![]() ×(1×10—2-
×(1×10—2-![]() ×1.68×10—2)mol=8×10—3mol,则焦亚硫酸钠的质量分数为
×1.68×10—2)mol=8×10—3mol,则焦亚硫酸钠的质量分数为![]() ×100%=76%,故答案为:当滴入最后一滴硫代硫酸钠溶液时,溶液由蓝色变为无色,且半分钟内不恢复;76%。
×100%=76%,故答案为:当滴入最后一滴硫代硫酸钠溶液时,溶液由蓝色变为无色,且半分钟内不恢复;76%。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案