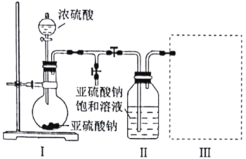
题目内容
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物![]() ,2元素可形成负一价离子。下列说法正确的是( )
,2元素可形成负一价离子。下列说法正确的是( )
A.X元素基态原子的电子排布式为![]()
B.X元素是第4周期第VA族元素
C.Y元素原子的轨道表示式为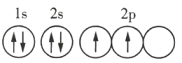
D.Z元素的单质Z2在氧气中不能燃烧
【答案】B
【解析】
X元素原子的4p轨道上有3个未成对电子,推知原子序数为33号,是As元素;Y元素原子的最外层2p轨道上有2个未成对电子,推知原子序数为8,是O元素;已知X、Y和Z三种元素的原子序数之和等于42,推知Z的原子序数为1,是氢元素;X与Y形成的化合物X2Y3是As2O3。
A.由分析知X为As,As元素基态原子的电子排布式为![]() ,故A项错误;
,故A项错误;
B.As元素是第4周期第ⅤA族元素,故B正确;
C.由分析知Y为氧元素,不是碳元素,而![]() 是碳元素原子的轨道表示式,故C错误;
是碳元素原子的轨道表示式,故C错误;
D.由分析知Z为氢元素,H2能在O2中燃烧,故D错误;
综上所述,答案为B。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目