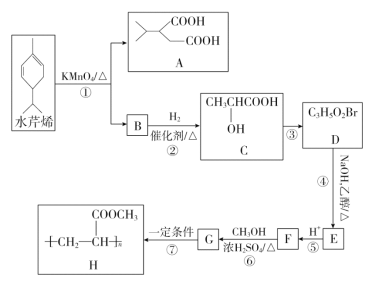
题目内容
【题目】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在 200℃和 10MPa 的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4 和 CH3OH 的燃烧热分别 784kJ/mol 和 628kJ/mol 则 2CH4(g)+O2(g)![]() 2CH3OH(g) △H=_____。
2CH3OH(g) △H=_____。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g) +H2O(g) △H<0。某温度下,,将 2.0molCO(g)和 6.0molH2(g)充入容积为 2L 的密闭容器中,反应到达平衡时, 改变压强和温度,平衡体系中 CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是_____。
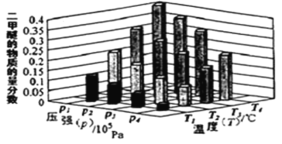
A.p3>p2,T3>T2
B.p1>p3,T1>T3
C.p1>p4,T2>T3
D.p2>p4,T4>T2
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g) +N2(g);
2CO2(g) +N2(g);
①200K、pPa时,在一个容积为 2L的恒温密闭容器中充入 1.5molNO 和 2.0molCO,开始反应至 2min 时测得 CO 转化率为 30%,则用N2表示的平均反应速率为v(N2)=_________;反应达到平衡状态时,测得二氧化碳为 0.8mol,则平衡时的压强为起始压强的_________倍(保留两位小数)。
②该反应在低温下能自发进行,该反应的ΔH_____0(填“>”、“<”)
(4)一定温度下,将NO2与SO2以体积比 1:2 置于密闭容器中发生反应NO2(g)+SO2(g) SO3(g)+NO(g),达到平衡时SO3的体积分数为 25%。该反应的平衡常数K= ______。
(5)利用原电池反应可实现NO2 的无害化,总反应为6NO2+ 8NH3=7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池正极区附近溶液 pH ____(填“变大”、“变小”或“不变”),负极电极反应式为 ____。
【答案】312kJ/mol BC 0.075mol/(L·min) 0.89 < 1.8 变大 2NH3-6e-+6OH-=N2+6H2O
【解析】
(1)根据CH4和CH3OH的燃烧热书写二者热化学方程式,结合盖斯定律进行计算;
(2)根据温度、压强等外界条件对平衡移动的影响及图中数据变化进行分析判断;
(3)①根据CO转化率计算消耗CO的物质的量,根据v =![]() 计算v(CO),再根据速率之比等于化学计量数之比计算v(N2);恒温恒容时,压强之比等于物质的量之比;
计算v(CO),再根据速率之比等于化学计量数之比计算v(N2);恒温恒容时,压强之比等于物质的量之比;
②由△H-T△S<0及反应中熵的变化来判断;
(4)相同条件下体积之比等于物质的量之比,列三段式计算;
(5)正极上是二氧化氮得到电子发生还原反应,负极是氨气失电子发生氧化反应,结合电极反应分析判断。
(1)CH4和CH3OH的燃烧热分别是784kJ/mol和628kJ/mol则①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-784kJ/mol,②CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-628kJ/mol,结合盖斯定律(①-②)2得到热化学方程式2CH4(g)+O2(g)=2CH3OH(g)△H=-312kJ/mol,答案为:-312kJ/mol;
O2(g)=CO2(g)+2H2O(l)△H=-628kJ/mol,结合盖斯定律(①-②)2得到热化学方程式2CH4(g)+O2(g)=2CH3OH(g)△H=-312kJ/mol,答案为:-312kJ/mol;
(2)由图可知,温度升高CO的转化率降低,说明升温平衡逆向移动,故正反应为放热反应,则温度越高二甲醚的质量分数越小,所以温度:T1>T2>T3>T4;正反应为气体体积减小的反应,增大压强平衡正向移动,二甲醚的质量分数增大,故压强:p1>p2>p3>p4,答案选:BC;
(3)①消耗CO物质的量为2.0mol30%=0.6mol,v(CO)= =0.15 mol/(Lmin),速率之比等于化学计量数之比,所以v(N2)=
=0.15 mol/(Lmin),速率之比等于化学计量数之比,所以v(N2)=![]() v(CO)=0.075 mol/(L·min);开始通入1.5molNO 和 2.0molCO,反应达到平衡状态时,测得二氧化碳为 0.8mol,列三段式为:
v(CO)=0.075 mol/(L·min);开始通入1.5molNO 和 2.0molCO,反应达到平衡状态时,测得二氧化碳为 0.8mol,列三段式为:

恒温恒容时,气体的压强之比等于物质的量之比,所以平衡时的压强为起始时压强的![]() =0.89,答案为:0.075 mol/(L·min);0.89;
=0.89,答案为:0.075 mol/(L·min);0.89;
②正反应为气体物质的量减小的反应,为熵减小的反应,即△S<0,而△H-T△S<0反应能自发进行,该反应在低温下能自发进行,所以该反应的△H<0;
(4)相同条件下体积之比等于物质的量之比,设NO2与SO2的物质的量分别为1mol、2mol,容器体积为1L,则NO2与SO2的初始浓度分别为1mol/L、2mol/L,列三段式为:
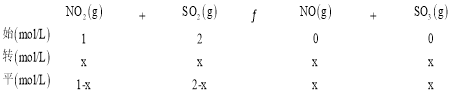
达到平衡时SO3的体积分数为25%,则![]() 100%=25%,解得x=0.75,该反应的平衡常数K=
100%=25%,解得x=0.75,该反应的平衡常数K=![]() =1.8;
=1.8;
(5)原电池工作时,负极发生氧化反应,正极发生还原反应,根据电池总反应6NO2+ 8NH3=7N2+12H2O,可知正极上是二氧化氮得到电子发生还原反应,电极反应式为:2NO2+8e-+4H2O=N2+8OH-,产生OH-,c(OH-)变大,pH变大;NH3在负极失去电子发生氧化反应,电极反应式为:2NH3-6e-+6OH-=N2+6H2O,答案为:变大;2NH3-6e-+6OH-=N2+6H2O。

 阅读快车系列答案
阅读快车系列答案