题目内容
【题目】某实验小组探究链状有机物X(H2C2O4)的结构及性质:
结构
已知:双键碳上连羟基不稳定。
(1)推测X可能的结构___________ 、____________(填结构简式)(X分子中无-O-O-结构)。
核磁共振氢谱显示X分子中只有一种氢原子,可以确定X分子为乙二酸。
性质探究:
查资料可知:乙二酸(HOOC-COOH)俗称草酸,易溶于水,属于二元中强酸,酸性强于碳酸,其熔点为101.5℃,在157℃升华。
类别角度:
(2)用化学方程式表征乙二酸类别通性中的两种性质:_________ 。
(3)在通性研究过程中,同学们发现:等物质的量的草酸和NaOH混合,溶液呈酸性,其原因可能与_____机理最接近。
a HCl溶液显酸性 b 苯酚溶液显酸性 c NaHSO3溶液显酸性
化合价角度:
(4)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMO4溶液,振荡,发现溶液的紫红色褪去,说明乙二酸具有___________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____MnO4-+ ____H2C2O4+ ____H+=____ Mn2++____CO2↑+____H2O。
特性角度:
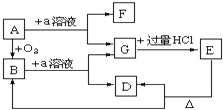
(5)同学网上查阅乙二酸性质,发现了以下实验:(夹持装置未标出)
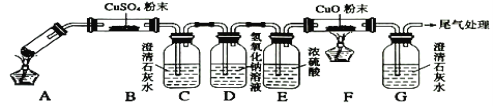
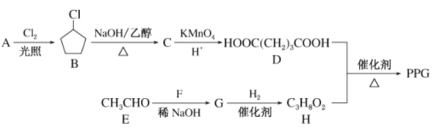
A中盛放少量草酸晶体,实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,据此回答:上述装置中,D的作用是__________。写出上述实验中草酸发生反应的方程式_______。
(6)小结草酸的化学性质___________。
【答案】HOOCCOOH HCOOCOOH ![]() +2NaOH
+2NaOH![]()
![]() +2H2O;
+2H2O;![]() +Na2CO3
+Na2CO3![]()
![]() +CO2↑+H2O c 还原性 2 5 6 2 10 8 吸收CO2气体 H2C2O4
+CO2↑+H2O c 还原性 2 5 6 2 10 8 吸收CO2气体 H2C2O4![]() CO↑+CO2↑+H2O 酸的通性、还原性、热不稳定性
CO↑+CO2↑+H2O 酸的通性、还原性、热不稳定性
【解析】
(5)A装置加热分解乙二酸,B装置中CuSO4粉末可以检验是否有水生成,C装置中澄清石灰水可以检验是否有CO2生成,D装置除去CO2,E装置再对气体进行干燥,再与灼热的CuO粉末反应,若有CO生成则可以将CuO还原成Cu单质,可以看到粉末由黑色变为红色,且G中澄清石灰水变浑浊。
(1)X的分子式为H2C2O4,不饱和度为2,应含有2个双键,又双键碳上连羟基不稳定,所以X可能的结构为HOOCCOOH或HCOOCOOH;
(2)乙二酸为二元中强酸,所以1mol草酸可以和2molNaOH反应,方程式为:![]() +2NaOH
+2NaOH![]()
![]() +2H2O;乙二酸酸性强于碳酸,所以可以和碳酸钠反应生成二氧化碳,方程式为:
+2H2O;乙二酸酸性强于碳酸,所以可以和碳酸钠反应生成二氧化碳,方程式为:![]() +Na2CO3
+Na2CO3![]()
![]() +CO2↑+H2O;
+CO2↑+H2O;
(3)等物质的量的乙二酸和NaOH混合反应生成NaHC2O4,溶液显酸性,说明HC2O4-的电离程度大于其水解程度,与NaHSO3溶液显酸性机理相似,所以选c;
(4)酸性高锰酸钾褪色说明高锰酸钾被还原,即乙二酸具有还原性;MnO4-→Mn2+,化合价降低5价,H2C2O4→CO2每个C化合价升高1价,则MnO4-与H2C2O4的系数比为2:5,再结合元素守恒可知方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(5)根据分析可知D装置是为了避免CO2对检验CO造成干扰而将二氧化碳吸收的装置;C中澄清石灰水变浑浊说明乙二酸分解产生二氧化碳,F中CuO粉末变红,G中澄清石灰水变浑浊说明有CO生成,B硫酸铜粉末变蓝说明有水生成,所以乙二酸发生的反应方程式为:H2C2O4![]() CO↑+CO2↑+H2O;
CO↑+CO2↑+H2O;
(6)根据以上分析和实验可知草酸的化学性质为:酸的通性、还原性、热不稳定性。

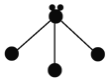
【题目】请根据所给图形回答下列问题:
⑴图表示容器中气体粒子的示意图,图中“![]() ”和“
”和“![]() ”分别代表不同元素的原子,它们的结合体代表分子,则图中可表示氮气的是______,可表示氯化氢(HCl)分子的是______,可表示一氧化碳和氧气的混合气体的是______(填序号)。
”分别代表不同元素的原子,它们的结合体代表分子,则图中可表示氮气的是______,可表示氯化氢(HCl)分子的是______,可表示一氧化碳和氧气的混合气体的是______(填序号)。
|
|
|
|
A | B | C | D |
⑵如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是______(填序号)。
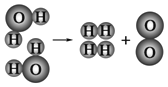
A 生成1mol O2需断开4mol H—O共价键
B 水分解后生成氢气和氧气的分子数比为2:1
C 水分解过程中,分子的种类不变
D 水分解过程中,原子的数目不变
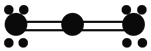
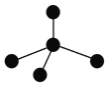
⑶表各图中的小球代表原子序数从1—18元素的原子实![]() 原子实是原子除最外层电子后剩余的部分
原子实是原子除最外层电子后剩余的部分![]() ,小黑点代表未用于形成共价键的最外层电子,短线代表共价键.下列各图表示的结构与化学式一定不相符的是______(填序号)。
,小黑点代表未用于形成共价键的最外层电子,短线代表共价键.下列各图表示的结构与化学式一定不相符的是______(填序号)。
A | B | C |
|
|
|
NH3 | CO2 | CCl4 |