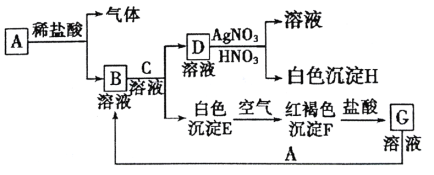
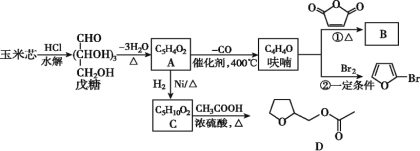
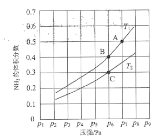
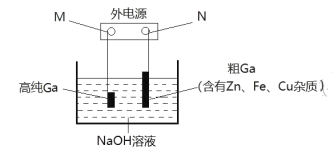
题目内容
【题目】下列是某同学对相应反应的离子方程式所作的评价,其中对应的评价合理的是( )
编号 | 化学反应 | 离子方程式 | 评价 |
A | 把MgSO4溶液滴入Ba(OH)2溶液 | Mg2++2OH-=Mg(OH)2↓ | 正确 |
B | 氧化铜与稀盐酸反应 | CuO+2H+=Cu2++H2O | 错误,不反应 |
C | 向FeCl2溶液中通入氯气 | Fe2++Cl2=Fe3++2Cl- | 错误,电荷不守恒 |
D | 向沸水滴入饱和氯化 铁溶液 | Fe3++3H2O | 正确 |
A.AB.BC.CD.D
【答案】C
【解析】
A项、硫酸镁和氢氧化钡反应MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓,氢氧化钡为易溶于水的强碱、硫酸镁为易溶于水的盐,两者都拆成离子,氢氧化镁沉淀和硫酸钡沉淀应写化学式,离子反应方程式为:Ba2++2OH-+Mg2++SO42-=BaSO4↓+Mg(OH)2↓,离子反应方程式、评价都错误,故A错误;
B项、氧化铜与稀盐酸反应在常温下即可进行,CuO+2H+═Cu2++H2O,离子反应方程式、评价都错误,故B错误;
C项、向氯化亚铁溶液中通入氯气发生反应2FeCl2+Cl2=2FeCl3,离子反应为2Fe2++Cl2=2Fe3++2Cl-,离子反应方程式错误,评价正确,故C正确;
D项、向沸水中滴加饱和氯化铁溶液制备Fe(OH)3胶体的离子反应为Fe3++3H2O![]() Fe(OH)3+3H+,离子反应方程式错误,故D错误;
Fe(OH)3+3H+,离子反应方程式错误,故D错误;
故选C。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】元素X、Y、Z和W在周期表中的位置如图所示,其中X、Y、Z均为短周期元素,且X、Y、W原子的最外层电子数之和为13。下列说法不正确的是( )
X | Y | ||
Z | |||
W |
A. 原子半径:![]()
B. W的最高价氧化物对应的水化物可能为强碱
C. 上述四种元素可形成化合物![]()
D. 一定条件下,Z单质与X的氢化物及Y的氢化物均能反应