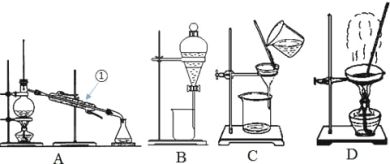
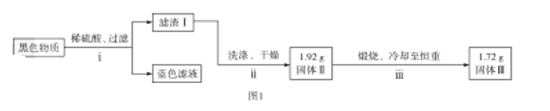
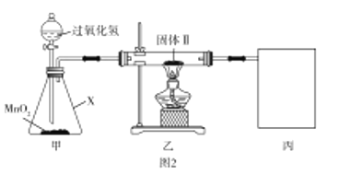
题目内容
【题目】在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,经10min后反应达到平衡,此时容器中气体的平均分子量为58。请计算(写出计算过程):
(1)10min内SO2的转化率;
(2)容器内反应前与平衡时的压强之比(最简整数比) ;
(3)该温度下的平衡常数。
【答案】60%;19/16;7.5L/mol
2SO2 + O2 == 2SO3
起始: 5 4.5 0
反应: 2X X 2X
平衡: 5-2X 4.5-X 2X
所以总物质的量为:5-2X+4.5-X+2X=9.5-X;由质量守恒定律,质量不变,为5×64+4.5×32=464g,所以![]() ,X=1.5mol。
,X=1.5mol。
(1)所以二氧化硫转化率为:2×1.5/5=60%
(2)恒容下压强比等于物质的量的比,(5+4.5):(9.5-1.5)=9.5:8=19:16
(3)达平衡时物质的量为:2mol,3mol,3mol;所以浓度为0.2mol/L,0.3mol/L,0.3mol/L,所以K=![]()
【解析】
2SO2 + O2 == 2SO3
起始: 5 4.5 0
反应: 2X X 2X
平衡: 5-2X 4.5-X 2X
所以总物质的量为:5-2X+4.5-X+2X=9.5-X;由质量守恒定律,质量不变,为5×64+4.5×32=464g,所以![]() ,X=1.5mol。
,X=1.5mol。
(1)所以二氧化硫转化率为:2×1.5/5=60%
(2)恒容下压强比等于物质的量的比,(5+4.5):(9.5-1.5)=9.5:8=19:16
(3)达平衡时物质的量为:2mol,3mol,3mol;所以浓度为0.2mol/L,0.3mol/L,0.3mol/L,所以K=![]()

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】下列是某同学对相应反应的离子方程式所作的评价,其中对应的评价合理的是( )
编号 | 化学反应 | 离子方程式 | 评价 |
A | 把MgSO4溶液滴入Ba(OH)2溶液 | Mg2++2OH-=Mg(OH)2↓ | 正确 |
B | 氧化铜与稀盐酸反应 | CuO+2H+=Cu2++H2O | 错误,不反应 |
C | 向FeCl2溶液中通入氯气 | Fe2++Cl2=Fe3++2Cl- | 错误,电荷不守恒 |
D | 向沸水滴入饱和氯化 铁溶液 | Fe3++3H2O | 正确 |
A.AB.BC.CD.D