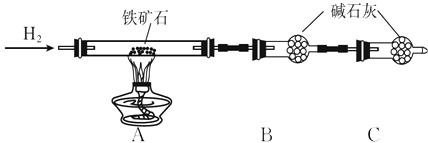
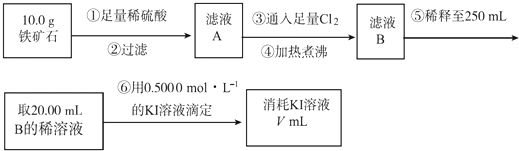
题目内容
【题目】NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.

试回答:
(1)A点沉淀为______,(填化学式)B点沉淀为________.(填化学式)
(2)原固体混合物中各物质的物质的量分别是多少?___________
(3)C点处的盐酸的体积是多少毫升? ____________
【答案】 Fe(OH)3 Al(OH)3,Fe(OH)3 原混合物中n(AlCl3)=0.03mol、n(FeCl3)=0.01mol、n(NaOH)=0.17mol 170mL.
【解析】向所得浊液中,逐滴加入1mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:①0-20mL,随盐酸的体积增加,生成沉淀的质量不变,说明A点沉淀是Fe(OH)3;m[Fe(OH)3]=1.07g,NaOH、AlCl3、FeCl3组成的混合物,溶于足量水发生反应是:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;②20mL处,加入20mL盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;③20mL-50mL,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓④50mL处,NaAlO2与盐酸恰好反应,需盐酸体积为:50mL-20mL=30mL,沉淀质量达到最大,溶液为NaCl溶液;⑤50ml-C点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Fe(OH)3+3HCl=FeCl3+3H2O;Al(OH)3+3HCl=AlCl3+3H2O;⑥C点,Fe(OH)3和Al(OH)3完全反应,溶液为FeCl3、AlCl3和NaCl混合液。(1) A处的沉淀为Fe(OH)3,因为加入20.0mLHCl恰好中和过量的NaOH,再加HCl沉淀增多,说明AlO2-转化为Al(OH)3,故A点沉淀为Fe(OH)3;20mL-50mL,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,故沉淀B为Al(OH)3,Fe(OH)3;(3)选50mL处,计算NaOH的质量,此时,溶液为NaCl溶液,溶液中Cl-来源于原混合物中的AlCl3、FeCl3和加入的50mLHCl,溶液中Na+来源于原混合物中的NaOH,即n(NaOH)= n(HCl)+ 3n(AlCl3)+ 3n(FeCl3)。
NaAlO2 + HCl + H2O=Al(OH)3↓+NaCl
0.03mol 0.03L×1mol/L=0.03mol
由Al原子守恒得原混合物中n(AlCl3)=n(NaAlO2)=0.03mol;
由Fe原子守恒得原混合物中n(FeCl3)=n[Fe(OH)3]= ![]() =0.01mol;
=0.01mol;
n(NaOH)= n(HCl)+ 3n(AlCl3)+ 3n(FeCl3)=0.05L×1mol/L+3×0.03mol+3×0.01mol=0.17mol;(4)由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=3n(FeCl3)+3n(AlCl3)+n(HCl)=0.01mol×3+0.03mol×3+0.05L×1mol/L=0.17mol,C点溶液为FeCl3、AlCl3和NaCl混合液,C点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH)=0.17mol;C点所表示盐酸的体积为:V=![]() =0.17L=170mL。
=0.17L=170mL。

 阅读快车系列答案
阅读快车系列答案