题目内容
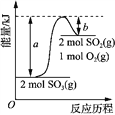
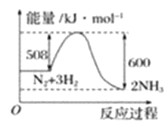
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A.2a=b<0B.b>d>0C.a<c<0D.2c=d>0
【答案】A
【解析】
四个反应均为放热反应,即a、b、c、d均小于0,根据物质的状态及计量数比较a、b、c、d之间的关系和大小。
A. 反应①和②所有物质聚集状态相同,且反应②的计量数是反应①的2倍,则2a=b,所有反应均为放热反应,即a、b、c、d均小于0,因此2a=b<0,A项正确;
B. 四个反应均为放热反应,即a、b、c、d均小于0,B项错误;
C. 反应①和③对比,H2O的状态不同,从气态变为液态要放出热量,因此反应③放出的热量更多,那么c < a <0,C项错误;
D. 反应③和④所有物质聚集状态相同,且反应④的计量数是反应③的2倍,则2c=d,所有反应均为放热反应,即a、b、c、d均小于0,因此2c=d <0,D项错误;
答案选A。

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
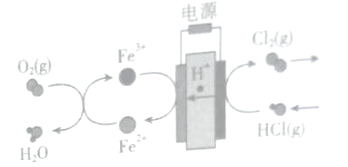
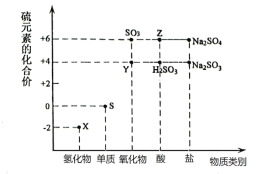
【题目】下列是某同学对相应反应的离子方程式所作的评价,其中对应的评价合理的是( )
编号 | 化学反应 | 离子方程式 | 评价 |
A | 把MgSO4溶液滴入Ba(OH)2溶液 | Mg2++2OH-=Mg(OH)2↓ | 正确 |
B | 氧化铜与稀盐酸反应 | CuO+2H+=Cu2++H2O | 错误,不反应 |
C | 向FeCl2溶液中通入氯气 | Fe2++Cl2=Fe3++2Cl- | 错误,电荷不守恒 |
D | 向沸水滴入饱和氯化 铁溶液 | Fe3++3H2O | 正确 |
A.AB.BC.CD.D