题目内容
【题目】已知A、B、C、D、G为中学化学中常见的物质,其中A为单质,B、C、D、G均为化合物。它们之间存在以下的相互转化关系:
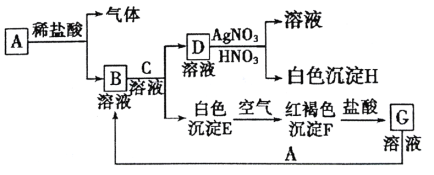
试回答:
(1)写出A的化学式___。
(2)如何用实验证明B溶液中是否含有G?(请写出实验的步骤、现象和结论)___。
(3)写出由E转变成F的化学方程式___。
(4)向G溶液中加入A的有关离子反应方程式___。
【答案】Fe 取少量B溶液于试管中,滴入几滴KSCN溶液,溶液显红色说明含有G,否则不含G 4Fe(OH)2+2H2O+O2=4Fe(OH)3 2Fe3++Fe=3Fe2+
【解析】
白色沉淀E在空气中变为红褐色沉淀F,则E是Fe(OH)2、F是Fe(OH)3,Fe(OH)3与盐酸反应生成氯化铁,G是FeCl3溶液;则可知A是Fe,铁与盐酸反应生成FeCl2和氢气,B是FeCl2;C是氢氧化钠,氢氧化钠与FeCl2反应生成Fe(OH)2和氯化钠,D是NaCl,NaCl与硝酸银反应生成AgCl沉淀和硝酸钠,则H是AgCl。
根据以上
(1)A是单质铁,化学式为Fe。
(2)B是FeCl2,G是FeCl3,Fe3+遇KSCN变红色,取少量B溶液于试管中,滴入几滴KSCN溶液,溶液显红色说明含有FeCl3,否则不含FeCl3。
(3)E是Fe(OH)2、F是Fe(OH)3,白色沉淀E在空气中变为红褐色沉淀F,化学方程式是4Fe(OH)2+2H2O+O2=4Fe(OH)3。
(4)向FeCl3溶液中加入铁粉生成FeCl2,反应方程式是2Fe3++Fe=3Fe2+。

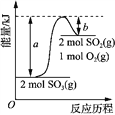
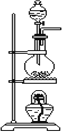
【题目】浓硫酸与木炭粉在加热条件下反应:C+H2SO4(浓)![]() CO2↑+SO2↑+2H2O
CO2↑+SO2↑+2H2O
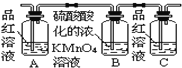
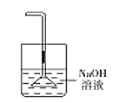
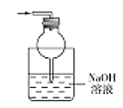
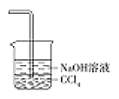
Ⅰ.第一小组用如图所示各装置设计一个实验,验证上述反应所产生的三种产物。
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
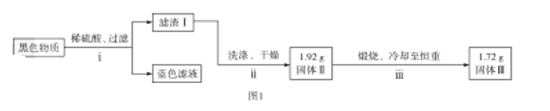
(1)这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):④→ → → 。___
(2)实验时可观察到装置A瓶的溶液褪色,C瓶的溶液不褪色;A瓶溶液变化体现了SO2___性;B瓶溶液的作用是___,B瓶中对应反应的离子方程式是___;C瓶溶液的作用是___。
(3)装置②中看到现象是___。
(4)装置③中所加试剂名称是___,现象是___。
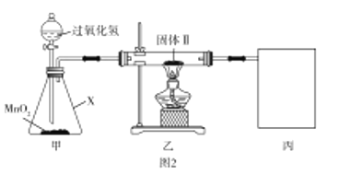
Ⅱ.另一个小组为测得CO2和SO2的质量,并计算两者物质的量之比,设计下列实验:
将生成气体依次通过X溶液→浓硫酸→碱石灰1→碱石灰2,并设法让气体完全被吸收。
(5)下列试剂中适合充当X的是___
A.BaCl2溶液 B.Ba(OH)2溶液
C.滴加H2O2的BaCl2溶液 D.滴加H2O2的Ba(OH)2溶液
(6)实验结束后,在X溶液中得到的沉淀通过过滤、洗涤、烘干、称重,称得质量为4.66g。称得碱石灰1(足量)在实验前后增重质量为1.32g。CO2和SO2物质的量比___。
【题目】下列是某同学对相应反应的离子方程式所作的评价,其中对应的评价合理的是( )
编号 | 化学反应 | 离子方程式 | 评价 |
A | 把MgSO4溶液滴入Ba(OH)2溶液 | Mg2++2OH-=Mg(OH)2↓ | 正确 |
B | 氧化铜与稀盐酸反应 | CuO+2H+=Cu2++H2O | 错误,不反应 |
C | 向FeCl2溶液中通入氯气 | Fe2++Cl2=Fe3++2Cl- | 错误,电荷不守恒 |
D | 向沸水滴入饱和氯化 铁溶液 | Fe3++3H2O | 正确 |
A.AB.BC.CD.D