��Ŀ����
����Ŀ��ijѧ��Ϊ̽��AgCl�������ܽ��ת������ʵ�鷽������¼���£�
��������� | ���� |
�������������Ũ�ȵ�AgNO3��Һ��NaCl��Һ��ϣ����ˣ�����ҺX�Ͱ�ɫ����Y | |
��������ҺX �еμӼ��α���KI��Һ | ���ɻ�ɫ����M |
����ȡ������ɫ����Y���μӼ��α���Na2S��Һ | ����Y ת��Ϊ��ɫ����Z |
����ȡ������ɫ����Y���μӼ���Ũ��ˮ | ����Y���ܽ� |
(1)�ɲ�����������Ʋ⣬��Һ X �г��˺���Na+��NO3-�������е�������_____��
(2)д������������ɺ�ɫ���� Z �����ӷ���ʽΪ_________________����ɫ����Y ת��Ϊ��ɫ���� Z ����Ҫԭ����___________��
(3)��֪��Ag+ + 2NH3�� H2OAg(NH3)2++2H2O����ƽ���ƶ�ԭ�����Ͳ�����м���Ũ��ˮ�������ܽ��ԭ��__________________��
(4)Ϊ�˽�һ��̽���������ܻ���������ܽ�Ķ����ԣ���ͬѧ���������¶Ա�ʵ�� V��
��ȡ������ɫ���� Z �ͻ�ɫ���� M����������֧�Թ���
��Ȼ��ֱ�μ�ͬ���ͬŨ�ȵ�ϡ���ᣬ�۲쵽��ɫ���� M ���ܽ⣬��ɫ���� Z �ܽ⣬��������ɫ����������ۺ�ʵ�����ʵ�� V ����Ϣ������Ԥ����ȷ����__________
A����ɫ���� Z �Ȼ�ɫ���� M ��������ˮ
B����ɫ���� Z �ܽ���ϡ��������Ϊ������������ԭ��Ӧ
C���ɲ���������Ʋ⣺ʵ���ҿ��ð�ˮϴ��������Ӧ����Թ�
D���ڲ����֮�����μ�Ũ��������� AgCl ��������
���𰸡�Ag+��Cl��(H+��OH-) 2AgCl(s)+S2��(aq)![]() Ag2S(s)+2Cl��(aq) ���¶��£�Ag2S��AgCl�ܽ�ȸ�С AgCl(g)
Ag2S(s)+2Cl��(aq) ���¶��£�Ag2S��AgCl�ܽ�ȸ�С AgCl(g)![]() Ag+(aq)+Cl��(aq)���������백���ӽ�ϣ���������Һ�������ӵ�Ũ�ȣ�ʹ����ƽ�������ƶ�����ʹAgCl�ܽ� BD
Ag+(aq)+Cl��(aq)���������백���ӽ�ϣ���������Һ�������ӵ�Ũ�ȣ�ʹ����ƽ�������ƶ�����ʹAgCl�ܽ� BD
��������
(1)�ɲ������Ļ���AgI��֪����ҺX�г��˺���Na+��NO3����������Ag+����ΪAgNO3��Һ��NaCl��Һ�������Ũ�ȣ�����Cl�����ӿ϶�����(��ȻH+��OH-Ҳ���ڣ�ֻ��Ũ�Ⱥ�С)����Ϊ��Ag+��Cl��(H+��OH-)��
(2)���¶��£�Ag2S��AgCl�ܽ�ȸ�С�����Ȼ���ת���������ķ�ӦΪ��2AgCl(s)+S2��(aq)![]() Ag2S(s)+2Cl��(aq)����Ϊ��2AgCl(s)+S2��(aq)
Ag2S(s)+2Cl��(aq)����Ϊ��2AgCl(s)+S2��(aq)![]() Ag2S(s)+2Cl��(aq)�����¶��£�Ag2S��AgCl�ܽ�ȸ�С��
Ag2S(s)+2Cl��(aq)�����¶��£�Ag2S��AgCl�ܽ�ȸ�С��
(3)�ڰ�ɫ����AgCl�У�����ƽ�⣺AgCl(g)![]() Ag+(aq)+Cl��(aq)���������백���ӽ�ϳ�Ag(NH3)2+����������Һ�������ӵ�Ũ�ȣ�ʹ����ƽ�������ƶ�����ʹAgCl�ܽ⡣��Ϊ��AgCl(g)
Ag+(aq)+Cl��(aq)���������백���ӽ�ϳ�Ag(NH3)2+����������Һ�������ӵ�Ũ�ȣ�ʹ����ƽ�������ƶ�����ʹAgCl�ܽ⡣��Ϊ��AgCl(g)![]() Ag+(aq)+Cl��(aq)���������백�����ӽ�ϣ���������Һ�������ӵ�Ũ�ȣ�ʹ����ƽ�������ƶ�����ʹAgCl�ܽ⣻
Ag+(aq)+Cl��(aq)���������백�����ӽ�ϣ���������Һ�������ӵ�Ũ�ȣ�ʹ����ƽ�������ƶ�����ʹAgCl�ܽ⣻
(4)A���������Ϣ֪��Ag2S��AgI���������ᣬ��û���ṩ�Ƚ�Ag2S��AgI��ˮ�е��ܽ��������ܷ�ת������Ϣ��������ȷ��Ag2S��AgI��ˮ���Դ�С��A����ȷ��
B��Ag2S(s)![]() 2Ag+(aq)+S2��(aq)�У�S2����ǿ��ԭ�ԣ�����������������Ũ���½������³����ܽ�ƽ�������ƶ���Ag2S�ܽ⣬B��ȷ��
2Ag+(aq)+S2��(aq)�У�S2����ǿ��ԭ�ԣ�����������������Ũ���½������³����ܽ�ƽ�������ƶ���Ag2S�ܽ⣬B��ȷ��
C���ɲ����������Ʋ⣬��ˮ���Խ��Ag+����������Ag��Ӧ��ʵ���Ҳ����ð�ˮϴ��������Ӧ����Թܣ�C����
D��Ag++2NH3��H2O![]() Ag(NH3)2++2H2O��H+��������һˮ�ϰ���ʹ��ƽ�������ƶ���c(Ag+)����c(Ag+)c(Cl��)>Ksp(AgCl)ʱ����ɫ����AgCl���ٴγ��֣�D��ȷ��
Ag(NH3)2++2H2O��H+��������һˮ�ϰ���ʹ��ƽ�������ƶ���c(Ag+)����c(Ag+)c(Cl��)>Ksp(AgCl)ʱ����ɫ����AgCl���ٴγ��֣�D��ȷ��
����BD��

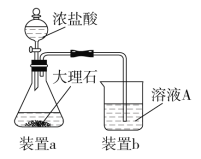
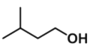
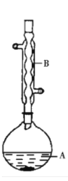
����Ŀ������������������۷���Ϣ�صijɷ�֮һ�������㽶����ζ��ʵ���ҿ��������������촼��Ũ������¼��ȷ�Ӧ�Ʊ�������������ʵ��װ��ʾ��ͼ���й��������£���ʵ����û�������Ϊ�ܼ���
 +
+
![]()
 +H2O
+H2O
���� | Ħ������(g/mol) | �ܶ�(g/mL) | �е�(��) | ˮ�е��ܽ��� |
���촼 | 88 | 0.81 | 131 | �� |
���� | 60 | 1.05 | 118 | ���� |
���������� | 130 | 0.80 | 142 | ���� |
������ | 84 | 0.78 | 81 | ���� |
ʵ�鲽�裺
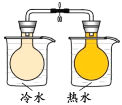
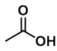
����A�м��� 4.4 g �����촼��6.0 g �ı����ᡢ1.0 mL Ũ���ᡢ25 mL ������ͽ�����ӡ�������A�Ϸ���������B����֤ĥ�����ܣ���������װ�ù̶���
�ڴ������貢��������A��ֱ���ܼ���ʼ���������ִ��¶ȼ��ȣ�ά����ϵ���� 50 ���ӡ�
�۷�ӦҺ�������º����Һ©���У���25mLˮϴһ�Σ�����5%̼��������Һϴ�����ԡ�
���������ˮϴ���л���һ�Σ��ֳ��IJ������������ˮ����þ���壬����Ƭ�̡�
�ݹ��˳�ȥ����þ���壬�����������ռ�������֣������������� 3.51 g��
(1)����B ������Ϊ_____________��
(2)������У��ڡ��������貢��������A��ǰ����©��һ����Ҫ����������©���������ʵ��ʧ�ܲ�������ַ��ա�����©�IJ���Ϊ _______________________��
(4)�������ͨ�����������ղ�Ʒʱ��ʵ����Ӧ��_________�� �����ռ���Ʒ��ͨ�����㣬��ʵ��IJ�����_____________��
(5)����ʵ�ĺϳ�ʵ���У���������װ�� A ��װ�� B ֮������һ����ˮ��(��ͼ)�����������ԭ���ǣ��ܼ�������ͷ�Ӧ�����ɵ�ˮ�γɶ�Ԫ���������ʱ���߹�ͬ�������������������ˮ���С���ʱ��ˮ����Һ��Ҳ��ֲ㣬��������ˮ�ִ���_________��(ѡ���ϻ���)������������ԭ����֪����ˮ���ڴ�ʵ��������������________����ˮ������һ��Ҫ��;�ǹ۲�Ϳ��Ʒ�Ӧ���ȡ����豾ʵ����ʴﵽ 100%���ҷ�Ӧ���ɵ�ˮ��ȫ����������ȫ���������ˮ���пɷ���õ���ˮ�����Ϊ_____mL��(ˮ���ܶ�ȡ1.00 g/mL��������Ũ�����е�ˮ��)

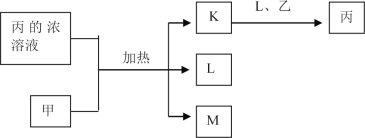
����Ŀ����Ԫ����Ҫ��Br-��ʽ�����ں�ˮ(��������)�У����ÿ����������Ӻ�ˮ�����壬��������ʾ����ͼ����֪�����������Һ̬�������ɫ���ӷ���
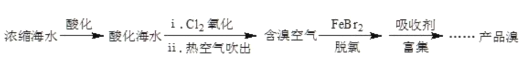
(1)��������д��i�еĻ�ѧ����ʽ_____��
(2)���ȣ���ȥ��������в�����Cl2��
�پ����������õ�������_____��
����Һʧȥ�������ú���FeBr2�����_____���������ûָ���
(3)��������ȡBr2��
��Na2CO3��Һ�����壬Br2�绯ΪBrO![]() ��Br-������H2SO4�ữ����Եõ�Br2��д������H2SO4�ữ����Br2�����ӷ���ʽ_____��
��Br-������H2SO4�ữ����Եõ�Br2��д������H2SO4�ữ����Br2�����ӷ���ʽ_____��
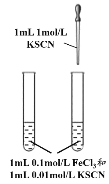
(4)̽��NaBr��Һ��H2SO4��Һ��ӦʱH2SO4Ũ�ȶ�����Br2��Ӱ�죬ʵ�����£�
��� | A | B | C |
�Լ���� | 1mol/LNaBr 20%H2SO4 | 1mol/LNaBr 98%H2SO4 | ��B�з�Ӧ����Һ��ˮ ϡ�� |
ʵ������ | ���������� | ��Һ���غ�ɫ������ | ��Һ��ɫ��ú�dz |
��B����Һ���غ�ɫ˵��������_____��
�ڷ���C����Һ��ɫ��dz��ԭ��ͬѧ��Ϊ�Ƿ����˻�ѧ��Ӧ���£���ͬѧ��Ϊ����ˮϡ�����¡�����Ϊ��ͬѧ�ķ������������þ���ķ�Ӧ˵�����ɡ�����Ϊ��ͬѧ�ķ������������һ�����ʵ�鷽��֤������Ӽ���ͬѧ��˵������ѡһ������
��Ϊ����������_____(���巴Ӧ)��
��Ϊ�Һ�����ʵ�鷽��_____��