题目内容
7.下列事实不能用平衡移动原理解释的是( )| A. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| B. | 增大压强,有利于SO2和O2反应生成SO3 | |
| C. | 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
分析 平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.
解答 解:A、催化剂加快反应速率,但不改变化学平衡,不能用平衡移动原理来解释,故A符合;
B、SO2和O2反应生成SO3为可逆反应,增大压强平衡发生移动,可用勒夏特列原理来解释,故B不符合;
C、该反应反应前后气体体积不变,所以压强不影响化学平衡的移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,所以不能用勒夏特列原理解释,故C符合;
D、对氯水中的次氯酸受光照射会分解,次氯酸浓度减小,使得化学平衡Cl2+H2O?HCl+HClO向右移动,能用勒夏特列原理解释,故D不符合.
故选AC.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.

练习册系列答案
相关题目
15.下列各组物质中含氧原子的物质的量相同的是( )
| A. | 0.3mol O2和 0.3mol H2O | |
| B. | 0.1mol H2SO4和3.6g H2O | |
| C. | 0.1mol MgSO4•7H2O和0.1mol C12H22O11(蔗糖) | |
| D. | 6.02×1023个CO2与0.1mol KMnO4 |
2.下列化学用语的表述对应正确的是( )
| A. | 碳酸氢钠的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ | |
| B. | 用铜做阳极电解氯化铜溶液的离子方程式:Cu2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑ | |
| C. | 硫化钠水解的离子方程式:S2-+2H2O═H2S+2OH- | |
| D. | 用TiCl4制备TiO2的化学方程式:TiCl4+(x+2)H2O(过量)?TiO2•x H2O↓+4HCl |
19. 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )
 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如下图所示.正极反应式为PbSO4+2Li++2e-=Li2SO4+Pb.下列说法不正确的是( )| A. | 放电过程中,Li+向正极移动 | |
| B. | 常温下电解质是不导电的固体,电池不工作 | |
| C. | 每转移0.1 mol 电子,理论上生成20.7 g Pb | |
| D. | 该电池总反应为 PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb |
16.下列离子方程式正确,且与所述事实相符的是( )
| A. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O | |
| B. | 向水中通氯气:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 在强碱溶液中,次氯酸钠与Fe(OH)3 反应生成Na2FeO4,离子方程式:3ClO-+2Fe(OH)3═2FeO42-+H2O+3Cl-+4H+ |
17.用KHC2O4(pKa1=1.23,pKa2=4.19)和K2C2O4配制缓冲溶液,其有效缓冲范围是( )
| A. | 0.23~2.23 | B. | 2.23~3.19 | C. | 3.19~5.19 | D. | 4.19~6.19 |
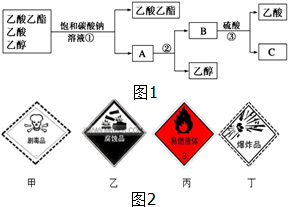 (1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.
(1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.