题目内容
17.已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱.此过程可以表示为:①NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
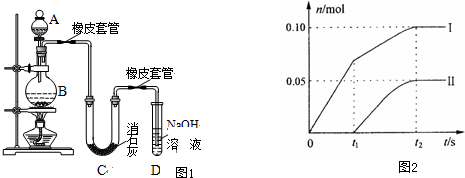
现某化学小组根据上述原理在实验室中模拟制碱过程,图1中C装置是溶有氨和NaCl的溶液,且二者均达到了饱和.
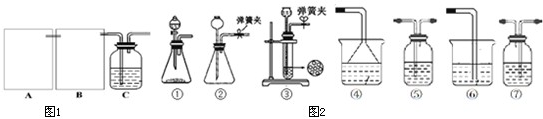
(1)制CO2时为了使反应随开随用,随关随停,图1中A方框内应选用以下③装置(填序号).简述该装置能随关随停的理由关闭弹簧夹后反应生成的气体使上部压强增大,到达一定程度后可把反应液压回漏斗,使固液分离从而停止反应.
(2)为使实验能够进行,在B方框内内应选用图2中的⑤装置(填写序号),该装置内应装入的试剂是饱和碳酸氢钠溶液.
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导下,他们对某个装置进行了改进,达到了实验目的.你认为他们的改进方法是将C装置浸泡在一个盛有冰水混合物的水槽里(或大烧杯中).
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为65%(产率为实际产量占理论产量的百分比).
分析 (1)制CO2时为了使反应随开随用,随关随停,需要应用启普发生器的装置原理,利用止水夹控制气体压强,使液体和固体分离停止反应,打开压强减小液体和固体接触继续反应;
(2)制备出二氧化碳气体中含有氯化氢气体,影响碳酸氢钠的生成,B装置中需要通过饱和碳酸氢钠溶液除去;则B装置为洗气装置;
(3)降低反应的温度,碳酸氢钠溶解度减小;
(4)依据化学方程式计算理论生成碳酸氢钠的质量,依据碳酸氢钠分解的化学方程式计算碳酸钠质量,结合实际生成碳酸钠的质量计算产率
解答 解:(1)启普发生器是随时进行,随时停止的装置,适用于固体和液体不加热反应生成不溶于水的气体制备反应,所以制CO2时为了使反应随开随用,随关随停应符合启普发生器的原理应用,应该选用装置③,利用止水夹控制气体压强,关闭弹簧夹后反应生成的气体使上部压强增大,到达一定程度后可把反应液压回漏斗,使液体和固体分离停止反应,打开压强减小液体和固体接触继续反应;
故答案为:③;关闭弹簧夹后反应生成的气体使上部压强增大,到达一定程度后可把反应液压回漏斗,使固液分离从而停止反应;
(2)制备出二氧化碳气体中含有氯化氢气体,影响碳酸氢钠的生成,B装置中需要通过饱和碳酸氢钠溶液除去;则B装置洗气装置,导气管长进短出,所以选择图中的装置⑤;
故答案为:⑤;饱和碳酸氢钠溶液;
(3)通过降低温度,减小碳酸氢钠的溶解度,使碳酸氢钠析出,所以将C装置浸泡在一个盛有冰水混合物的水槽里(大烧杯)可以达到目的;
故答案为:将C装置浸泡在一个盛有冰水混合物的水槽里(或大烧杯中);
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,理论上依据化学方程式计算:NH3+CO2+H2O+NaCl=NaHCO3+NH4Cl;得到碳酸氢钠质量为8.4g,分解生成碳酸钠质量依据化学方程式计算:2NaHCO3=Na2CO3+H2O+CO2↑;碳酸钠的质量为5.3g;实验后得到干燥的NaHCO3晶体的质量为5.46g,生成碳酸钠质量为:
2NaHCO3 =Na2CO3+H2O+CO2↑;
168 106
5.46g 3.445g
假设第二步分解时没有损失,则碳酸钠的产率=$\frac{3.445g}{5.3g}$×100%=65%;
故答案为:65%.
点评 本题考查了纯碱制备原理的实验应用,此题是一道实验探究综合题,该题综合性强难度较大,侧重于考查学生对基础知识的综合应用能力和实验探究能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 阳极反应为Fe-2e-═Fe2+ | |
| B. | 过程中有Fe(OH)3沉淀生成 | |
| C. | 电路中每转移12mol电子,最多有1molCr2O72-被还原 | |
| D. | 如果石墨做阴阳极,电解过程不变 |
Ⅰ.工业上生产重铬酸钠晶体(Na2Cr2O7•2H2O)常以铬铁矿[主要成分:FeCr2O4(亚铬酸亚铁)]为原料,其主要步骤如下:
①4FeCr2O4+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2
②用H2SO4调节溶液pH,使Na2CrO4转化为Na2Cr2O7
(1)工业上步骤①在反应过程中需不断搅拌,其目的是增大反应物的接触面积,加快反应速率.
(2)已知:Cr2O72-+H2O?2CrO42-+2H+,写出步骤②Na2CrO4转化为Na2Cr2O7的化学方程式2Na2CrO4+H2SO4═Na2C2O7+Na2SO4+H2O.
Ⅱ.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁)生产碱式硫酸铁的工艺流程如图:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | A1(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(4)加入少量NaHCO3的目的是调节溶液的pH,应控制pH的范围区间为[4.4~7.5).
(5)在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入2.8L O2(标准状况),则相当于节约NaNO2的质量为34.5g.
(6)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为2[Fe(OH)]2++2H2O═[Fe2(OH)4]2++2H+.
Ⅲ.铁的化合物也是制备高能锂电池的重要原料.已知LiFePO4电池反应为FePO4+Li $?_{充电}^{放电}$LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时阳极反应式LiFePO4-e-═FePO4+Li+.常温下以该电池为电源电解500mL饱和食盐水,当消耗0.35g Li时,溶液的pH为13(忽略溶液的体积变化).
| A. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| B. | 增大压强,有利于SO2和O2反应生成SO3 | |
| C. | 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |

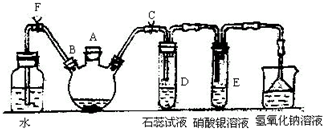 实验室制备溴苯可用如图所示的装置,填写下列空白:
实验室制备溴苯可用如图所示的装置,填写下列空白: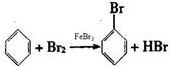 .
.