题目内容
18.硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.
步骤2 向处理过的铁屑中加入过量的3mol•L-1H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有②④⑤(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中趁热过滤,其原因是防止溶液冷却时,硫酸亚铁因析出而损失;
(3)在步骤3制的硫酸亚铁铵晶体常含有Fe3+杂质.检验Fe3+的试剂可以用K4〔Fe(CN)6〕生成普鲁士蓝沉淀,有关的离子方程式是K++Fe3++[Fe(CN)6]4-=KFe[Fe(CN)6]↓.
(4)制得的晶体经过过滤后用无水乙醇洗涤而不用蒸馏水,理由是①硫酸亚铁铵晶体在乙醇中的溶解度小,可减小晶体在洗涤时应溶解而损失;②酒精易挥发,不会附着在晶体表面;(任说两点)
(5)在25℃时,相同物质的量浓度的(NH4)2CO3、(NH4)2SO4、硫酸亚铁铵三种盐溶液a、b、c,其铵根离子浓度由小到大的排列顺序为a<b<c(用a、b、c回答)
分析 步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,碳酸钠溶液中碳酸根离子水解导致溶液呈碱性,碱有利于油脂水解,铁和碳酸钠不反应,然后分离出液体,用水洗净铁屑;
步骤2 向处理过的铁屑中加入过量的3mol•L-1H2SO4溶液,发生的反应为Fe+H2SO4=FeSO4+H2↑,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液;
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体;
(1)步骤1的操作是加热、溶解,根据仪器的作用选取仪器;
(2)硫酸亚铁的溶解度随着温度的升高而增大;
(3)在步骤3制的硫酸亚铁铵晶体常含有Fe3+杂质,Fe3+的试剂可以用K4〔Fe(CN)6〕生成普鲁士蓝沉淀,根据反应物和生成物书写离子方程式;
(4)制得的晶体在无水乙醇中的溶解度小于在蒸馏水水中的溶解度;且乙醇挥发性较好;
(5)在25℃时,相同物质的量浓度的(NH4)2CO3、(NH4)2SO4、硫酸亚铁铵三种盐溶液a、b、c,其铵根离子水解程度越大,则溶液中铵根离子浓度越小.
解答 解:步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,碳酸钠溶液中碳酸根离子水解导致溶液呈碱性,碱有利于油脂水解,铁和碳酸钠不反应,然后分离出液体,用水洗净铁屑;
步骤2 向处理过的铁屑中加入过量的3mol•L-1H2SO4溶液,发生的反应为Fe+H2SO4=FeSO4+H2↑,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液;
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体;
(1)步骤1的操作是加热、溶解,加热需要酒精灯、盛放液体需要锥形瓶、需要玻璃棒搅拌、需要铁架台放置锥形瓶,所以不需要的仪器是②④⑤,故答案为:②④⑤;
(2)硫酸亚铁的溶解度随着温度的升高而增大,为了减少硫酸亚铁的析出,应该趁热过滤,故答案为:防止溶液冷却时,硫酸亚铁因析出而损失;
(3)在步骤3制的硫酸亚铁铵晶体常含有Fe3+杂质,Fe3+的试剂可以用K4〔Fe(CN)6〕生成普鲁士蓝沉淀,离子反应方程式为K++Fe3++[Fe(CN)6]4-=KFe[Fe(CN)6]↓,
故答案为:K++Fe3++[Fe(CN)6]4-=KFe[Fe(CN)6]↓;
(4)制得的晶体在无水乙醇中的溶解度小于在蒸馏水水中的溶解度;且乙醇挥发性较好,所以用乙醇洗涤能减小晶体因溶解而损失,故答案为:
①硫酸亚铁铵晶体在乙醇中的溶解度小,可减小晶体在洗涤时应溶解而损失;
②酒精易挥发,不会附着在晶体表面;
(5)在25℃时,相同物质的量浓度的(NH4)2CO3、(NH4)2SO4、硫酸亚铁铵三种盐溶液a、b、c,其铵根离子水解程度越大,则溶液中铵根离子浓度越小,亚铁离子抑制铵根离子水解、碳酸根离子促进铵根离子水解,所以溶液中铵根离子浓度从小到大顺序是a<b<c,故答案为:a<b<c.
点评 本题考查物质制备实验方案,为高频考点,涉及基本操作、盐类水解、离子检验等知识点,明确实验原理是解本题关键,知道铁离子、亚铁离子的检验方法,题目难度不大.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案Ⅰ.工业上生产重铬酸钠晶体(Na2Cr2O7•2H2O)常以铬铁矿[主要成分:FeCr2O4(亚铬酸亚铁)]为原料,其主要步骤如下:
①4FeCr2O4+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2
②用H2SO4调节溶液pH,使Na2CrO4转化为Na2Cr2O7
(1)工业上步骤①在反应过程中需不断搅拌,其目的是增大反应物的接触面积,加快反应速率.
(2)已知:Cr2O72-+H2O?2CrO42-+2H+,写出步骤②Na2CrO4转化为Na2Cr2O7的化学方程式2Na2CrO4+H2SO4═Na2C2O7+Na2SO4+H2O.
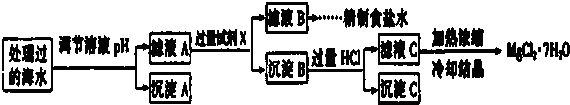
Ⅱ.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁)生产碱式硫酸铁的工艺流程如图:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | A1(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(4)加入少量NaHCO3的目的是调节溶液的pH,应控制pH的范围区间为[4.4~7.5).
(5)在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入2.8L O2(标准状况),则相当于节约NaNO2的质量为34.5g.
(6)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为2[Fe(OH)]2++2H2O═[Fe2(OH)4]2++2H+.
Ⅲ.铁的化合物也是制备高能锂电池的重要原料.已知LiFePO4电池反应为FePO4+Li $?_{充电}^{放电}$LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时阳极反应式LiFePO4-e-═FePO4+Li+.常温下以该电池为电源电解500mL饱和食盐水,当消耗0.35g Li时,溶液的pH为13(忽略溶液的体积变化).
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前 v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3 的转化率小于80% |
(1)将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,配平下列离子方程式:
2Fe(OH)3+3ClO-+OH-═2FeO42-+3Cl-+5H2O
(2)用Fe做阳极,Cu做阴极,NaOH溶液做电解液,用电解的方法也可制得Na2FeO4,则电解过程中阳极的反应式为Fe+8OH--6e-=FeO42-+4H2O.
(3)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
注:离子浓度小于10-5mol/L 可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=1.0×10-12;操作过程中溶液体积的变化忽略不计.
①表格中的a>0.16 (填“<”或“=”或“>”).
②沉淀A的组成为Fe(OH)3(填化学式);在调节溶液pH时,理论上应调节的pH的范围是3≤pH<9.
③加入的过量试剂X为Ba(OH)2 (填化学式).
④加入过量HCl的作用为使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解.
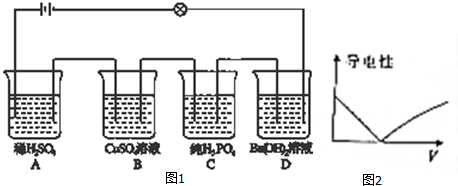
| A. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| B. | 增大压强,有利于SO2和O2反应生成SO3 | |
| C. | 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
| A. | 过氧化钠、氯水、浓硝酸通常都要密封保存于棕色试剂瓶中 | |
| B. | 盛溴的试剂瓶里加少量水以减少溴的挥发 | |
| C. | 钾、钠、白磷都应保存在水中 | |
| D. | 做焰色反应实验时所用铂丝,每次用完后用稀硫酸洗涤后再使用 |