题目内容
12.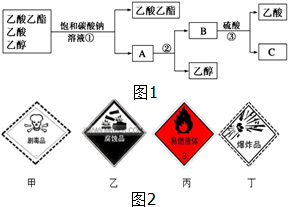 (1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.
(1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.(2)乙酸乙酯是一种重要的化工产品,在储存和运输乙酸乙酯产品的容器上,必须贴上如图2中标签中的丙.
分析 (1)乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离,溶液中的主要成分为乙酸钠和乙醇,蒸馏可得到乙醇,乙酸钠加入硫酸,蒸馏可得到乙酸;
(2)乙酸乙酯为易燃烧的液体,无毒,不具有腐蚀性,不能爆炸.
解答 解:(1)乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离,溶液中的主要成分为乙酸钠和乙醇,二者沸点相差较大,蒸馏可得到乙醇,乙酸钠加入硫酸,得到乙酸和硫酸钠,二者沸点相差较大,蒸馏可得到乙酸,
故答案为:分液;蒸馏;蒸馏;
(2)乙酸乙酯为易燃烧的液体,无毒,不具有腐蚀性,不能爆炸,则必须贴上如图2中标签中的丙,故答案为:丙.
点评 本题考查物质的分离、提纯的实验方案,题目难度不大,侧重于考查学生分析能力、实验能力,注意把握物质的性质的异同.

练习册系列答案
相关题目
3.目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点.
(1)将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,配平下列离子方程式:
2Fe(OH)3+3ClO-+OH-═2FeO42-+3Cl-+5H2O
(2)用Fe做阳极,Cu做阴极,NaOH溶液做电解液,用电解的方法也可制得Na2FeO4,则电解过程中阳极的反应式为Fe+8OH--6e-=FeO42-+4H2O.
(3)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2•7H20,过程如下:
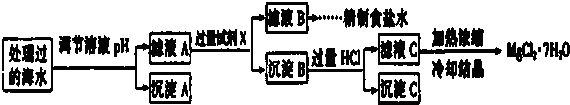
注:离子浓度小于10-5mol/L 可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=1.0×10-12;操作过程中溶液体积的变化忽略不计.
①表格中的a>0.16 (填“<”或“=”或“>”).
②沉淀A的组成为Fe(OH)3(填化学式);在调节溶液pH时,理论上应调节的pH的范围是3≤pH<9.
③加入的过量试剂X为Ba(OH)2 (填化学式).
④加入过量HCl的作用为使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解.
(1)将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,配平下列离子方程式:
2Fe(OH)3+3ClO-+OH-═2FeO42-+3Cl-+5H2O
(2)用Fe做阳极,Cu做阴极,NaOH溶液做电解液,用电解的方法也可制得Na2FeO4,则电解过程中阳极的反应式为Fe+8OH--6e-=FeO42-+4H2O.
(3)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |

注:离子浓度小于10-5mol/L 可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=1.0×10-12;操作过程中溶液体积的变化忽略不计.
①表格中的a>0.16 (填“<”或“=”或“>”).
②沉淀A的组成为Fe(OH)3(填化学式);在调节溶液pH时,理论上应调节的pH的范围是3≤pH<9.
③加入的过量试剂X为Ba(OH)2 (填化学式).
④加入过量HCl的作用为使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解.
7.下列事实不能用平衡移动原理解释的是( )
| A. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| B. | 增大压强,有利于SO2和O2反应生成SO3 | |
| C. | 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
2.某烯烃的结构简式为: ,其命名正确的是( )
,其命名正确的是( )
 ,其命名正确的是( )
,其命名正确的是( )| A. | 2-甲基-4-乙基-4-戊烯 | B. | 2-异丁基-1-丁烯 | ||
| C. | 4-甲基-2-乙基-1-戊烯 | D. | 2,4-二甲基-3-己烯 |
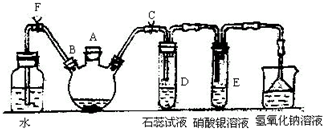 实验室制备溴苯可用如图所示的装置,填写下列空白:
实验室制备溴苯可用如图所示的装置,填写下列空白: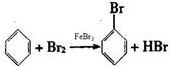 .
.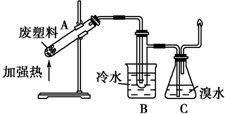 .塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题:
.塑料制品是人类日常生活中使用量最大的合成高分子材料.大量塑料制品的生产和使用,给人们的生活带来了极大的方便,同时也造成了严重的环境问题--白色污染.当今白色污染问题已得到了人们应有的重视,一些科学家也成功地寻找到了治理白色污染的有效途径.结合学过的知识,回答下列问题: .
.