题目内容
15.已知某强氧化剂RO(OH)2+ 中的R元素被Na2SO3还原到低价态.如果还原2.4×10-3mol RO(OH)2+ 至较低价态,需要60 mL 0.1 mol/L的Na2SO3溶液.那么,R元素被还原成的价态是( )| A. | -1 | B. | 0 | C. | +1 | D. | +2 |
分析 该氧化还原反应中,亚硫酸钠被氧化生成硫酸钠,则S元素化合价由+4价变为+6价,根据转移电子相等计算R被还原成的化合价,据此分析解答.
解答 解:该氧化还原反应中,亚硫酸钠被氧化生成硫酸钠,则S元素化合价由+4价变为+6价,设R元素被还原呈的化合价为x,根据转移电子相等得:2.4×10-3mol×(5-x)=0.1mol/L×0.06L×(6-4),x=0,
故选B.
点评 本题考查氧化还原反应的有关计算,把握元素化合价变化及转移电子守恒即可解答,注意RO(OH)2+ 中R元素化合价,题目难度不大.

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
5.下列叙述错误的是( )
| A. | 苯、乙烯都既能发生加成反应,也能发生氧化反应 | |
| B. | 塑料、橡胶和合成纤维都属于有机高分子化合物 | |
| C. | 糖类、脂肪和蛋白质在一定条件下都能发生水解反应 | |
| D. | 分子式为C5H12的有机物有三种,它们属于同分异构体 |
3.现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是:①观察颜色;②石蕊试剂;③品红溶液( )
| A. | ①②③ | B. | 只有①③ | C. | 只有②③ | D. | 只有① |
10.a毫升A、B、C三种气态烃任意比的混合物跟足量氧气混合点燃后,恢复到原常温常压状态,气体体积共缩小了2.5a毫升,那么A、B、C三种烃可能是( )
| A. | CH4、C2H6、C3H8 | B. | C2H4、C2H6、CH4 | C. | CH4、C2H2、C2H6 | D. | C2H6、C3H6、C4H6 |
20.化学平衡常数(K)、电离常数(Ka)、溶度积常数(Ksp)是判断物质性质或变化的重要的常数.下列关于这些常数的说法中,正确的( )
| A. | 化学平衡常数的大小与温度、浓度、压强、催化剂有关 | |
| B. | CH3COONH4溶液几乎呈中性,说明Ka(CH3COOH)与 Kb(NH3•H2O)近似相等 | |
| C. | Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(s)+I-═AgI(s)+Cl-不能够发生 | |
| D. | Ka(HCN)<Ka(CH3COOH)说明相同浓度时,氢氰酸的酸性比醋酸强 |
7.下列化合物中所含化学键类型完全相同的一组是( )
| A. | NaCl和CO2 | B. | HCl和H2O | C. | NaOH和H2O2 | D. | C12和CaCl2 |
4.短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
请回答:
(1)X2Z的电子式是 ;M2Z中所含化学键类型是离子键.
;M2Z中所含化学键类型是离子键.
(2)Y的非金属性比N强(填“强”或“弱”),能证明此结论的事实是CO 2+H 2O+SiO32-=H 2SiO 3↓+CO 32-(用离子方程式表示).
(3)YX4的结构简式为CH4;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物最多有5种.
| 元素 | 有关信息 |
| X | 在元素周期表中原子半径最小 |
| Y | 最外层电子数是次外层的2倍 |
| Z | 元素的主要合价为一2价 |
| M | 其单质及化合物的焰色反应呈黄色 |
| N | 与Y同主族,其单质为半导体 |
(1)X2Z的电子式是
 ;M2Z中所含化学键类型是离子键.
;M2Z中所含化学键类型是离子键.(2)Y的非金属性比N强(填“强”或“弱”),能证明此结论的事实是CO 2+H 2O+SiO32-=H 2SiO 3↓+CO 32-(用离子方程式表示).
(3)YX4的结构简式为CH4;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物最多有5种.
12.卤族元素的单质、化合物在生产生活中有较多的用途.
(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键
(3)根据第一电离能(数据见下表),最有可能生成稳定单核阳离子的卤素原子是I
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图Ⅰ、Ⅱ所示:
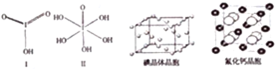
则二者酸性相对强弱是HIO3>H5IO6(填“>”、“<”或“=”).
(5)已知ClO2-为V形结构,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3与ClO2-为等电子体的是Cl2O或OF2(写出其中一个的化学式)
(6)关于碘晶体(晶体结构见上图)的以下说法中正确的是AD
A.2种取向不同排列的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(晶胞结构见上图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为$\frac{a{\;}^{3}ρN{\;}_{A}}{4}$.
(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键
(3)根据第一电离能(数据见下表),最有可能生成稳定单核阳离子的卤素原子是I
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |

则二者酸性相对强弱是HIO3>H5IO6(填“>”、“<”或“=”).
(5)已知ClO2-为V形结构,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3与ClO2-为等电子体的是Cl2O或OF2(写出其中一个的化学式)
(6)关于碘晶体(晶体结构见上图)的以下说法中正确的是AD
A.2种取向不同排列的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(晶胞结构见上图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为$\frac{a{\;}^{3}ρN{\;}_{A}}{4}$.
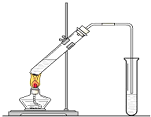 如图,在一支试管中先加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸;按图连接好装置,用酒精灯缓慢加热,观察现象.
如图,在一支试管中先加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸;按图连接好装置,用酒精灯缓慢加热,观察现象. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.