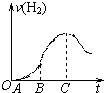
题目内容
13.X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,X元素可以组成M和N两种气态单质,反应M+2I-+2H+═I2+N+H2O常作为M的鉴定反应.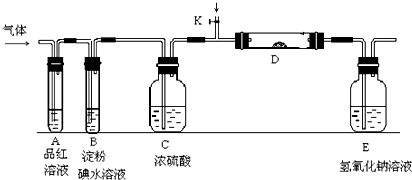
(1)M与N的关系为同素异形体.
(2)写出实验室制取W2的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)成都七中某化学兴趣小组设计如图所示的实验装置(图中夹持和加热装置略去).分别探究YX2和W2的性质.
①分别通入YX2和W2时,在装置A中观察到的现象是否相同?相同(填“相同”或“不相同”).
若装置D中装的是铁粉,当通入W2时观察到的现象为产生棕黄色的烟;
若装置D中装的是五氧化二钒(V2O5),当通入YX2时,打开K放入适量的氧气,在D装置中发生反应的化学方程式为2SO2+O2$\frac{\underline{\;V_{2}O_{5}\;}}{△}$2SO3.
②若装置B中装有5.0mL1.0×10-3mol/L的碘水,当通入足量的W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为5Cl2+I2+6H2O═2HIO3+10HCl.
(4)某同学将足量的YX2通入一支装有BaCl2溶液的试管,未见沉淀生成,向该试管中加入适量(填字母)5Cl2+I2+6H2O═2HIO3+10HCl,可以看到白色沉淀产生.
A.氨水 B.稀盐酸 C.稀硝酸 D.CaCl2
(5)若Y和X组成的负二价阴离子Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有黄色沉淀生成,取上层清液加入BaCl2溶液,有白色沉淀生成,该反应的粒子方程式为S2O32-+Cl2+H2O═SO42-+S↓+2Cl-+2H+.
(6)Y,W两种元素可形成化学式为YW2,Y2W2等化合物,则YW2的电子式为
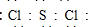 ,Y2W2的结构式为Cl-S-S-Cl.
,Y2W2的结构式为Cl-S-S-Cl.
分析 X、Y和W为原子序数依次递增的短周期元素,X元素可以组成M和N两种气态单质,反应M+2I-+2H+═I2+N+H2O常作为M的鉴定反应,则M具有强氧化性,应该为臭氧,则N为氧气,则X为O元素,X和Y同主族,则Y为S元素;Y和W的气态氢化物具有相同的电子数,且原子序数W大于Y,则W为Cl元素,
(1)M为臭氧、N为氧气,二者为同种元素形成的不同单质;
(2)W2为氯气实验室用浓盐酸与二氧化锰在加热条件下反应制取氯气;
(3)①二氧化硫和氯气都能够使品红溶液褪色;铁粉与氯气加热反应生成氯化铁,产生棕黄色的烟;二氧化硫催化氧化生成三氧化硫;
②根据n=cV计算出碘单质的物质的量,再根据注意的电子的物质的量计算出反应后碘元素的化合价,从而得出氧化产物,然后写出该反应的化学方程式;
(4)二氧化硫不与氯化钡反应,但是加入具有氧化性或碱性的试剂后二氧化硫被氧化成硫酸根离子,则会生成白色沉淀,据此进行判断;
(5)根据S和O元素的质量比计算出其物质的量之比,从而得出Z的化学式;Z与氯气反应生成黄色沉淀,该沉淀为S单质;取上层清液加入BaCl2溶液,有白色沉淀生成,该生成为硫酸钡,则反应生成了硫酸根离子,据此结合化合价变化相等写出反应的离子方程式;
(6)SCl2分子中S原子和两个Cl原子共用两对电子,每个Cl原子和S原子共用一对电子,这样所有原子都达到稳定结构;S2Cl2分子中各原子最外层均满足8电子稳定结构,电子式为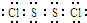 ,据此写出其结构简式.
,据此写出其结构简式.
解答 解:X、Y和W为原子序数依次递增的短周期元素,X元素可以组成M和N两种气态单质,反应M+2I-+2H+═I2+N+H2O常作为M的鉴定反应,则M具有强氧化性,应该为臭氧,则N为氧气,则X为O元素,X和Y同主族,则Y为S元素;Y和W的气态氢化物具有相同的电子数,且原子序数W大于Y,则W为Cl元素,
(1)根据分析可知,M为O3、N为O2,二者都是氧元素形成的不同单质,则二者互为同素异形体,
故答案为:同素异形体;
(2)W2为Cl2,实验室制取氯气的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)①YX2和W2分别为SO2和Cl2,氯气溶于水生成次氯酸,次氯酸能够漂白品红溶液,二氧化硫也能够漂白溶液,所以分别通入SO2和Cl2时,在装置A中观察到的现象相同;
若装置D中装的是铁粉,当通入Cl2时,铁与氯气加热反应生成氯化铁,会产生棕黄色的烟;
二氧化硫在催化剂存在条件下与氧气反应生成,反应的化学方程式为:2SO2+O2$\frac{\underline{\;V_{2}O_{5}\;}}{△}$2SO3,
故答案为:相同;产生棕黄色的烟;2SO2+O2$\frac{\underline{\;V_{2}O_{5}\;}}{△}$2SO3;
②若装置B中装有5.0mL1.0×10-3mol/L的碘水,碘单质的物质的量为:5.0×10-6mol,当通入足量的Cl2完全反应后,转移了5.0×10-5mol电子,则碘元素反应后化合价升高的价数为:$\frac{5×1{0}^{-5}}{5×1{0}^{-6}×2}$=5,则反应后碘元素的化合价为+5价,生成产物为HIO3,则该反应的化学方程式为:5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O═2HIO3+10HCl;
(4)二氧化硫不与氯化钡反应,则某同学将足量的YX2通入一支装有BaCl2溶液的试管,未见沉淀生成,当通入氨气后,二氧化硫与氨气反应生成亚硫酸根离子,亚硫酸根离子与钡离子反应生成亚硫酸钡沉淀;若加入稀硝酸,稀硝酸将二氧化硫氧化成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀,所以AC正确,
故答案为:AC;
(5)若S和O组成的负二价阴离子Z,Z中S和O的质量比为Y:X=4:3,二者的物质的量之比为:$\frac{4}{32}$:$\frac{3}{16}$=2:3,则Z为S2O32-;当Cl2与含S2O32-的溶液完全反应后,有黄色沉淀生成,说明生成的S电子;取上层清液加入BaCl2溶液,有白色沉淀生成,说明反应还生成了硫酸根离子,则该反应的粒子方程式为S2O32-+Cl2+H2O═SO42-+S↓+2Cl-+2H+,
故答案为:S2O32-+Cl2+H2O═SO42-+S↓+2Cl-+2H+;
(6)S、Cl两种元素可形成化学式为SCl2、S2Cl2等化合物,SCl2分子中S原子和两个Cl原子共用两对电子,每个Cl原子和S原子共用一对电子,这样所有原子都达到稳定结构,则SCl2的电子式为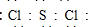 ;
;
S2Cl2分子中各原子最外层均满足8电子稳定结构,电子式为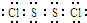 ,则其结构简式为:Cl-S-S-Cl,
,则其结构简式为:Cl-S-S-Cl,
故答案为: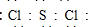 ;Cl-S-S-Cl.
;Cl-S-S-Cl.
点评 本题考查了性质实验方案的设计,题目难度中等,涉及常见元素推断、电子式、结构简式、离子方程式、化学方程式的书写、同素异形体的判断及性质实验方案的设计与评价等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案| A. | ①②③ | B. | 只有①③ | C. | 只有②③ | D. | 只有① |
| 元素 | 有关信息 |
| X | 在元素周期表中原子半径最小 |
| Y | 最外层电子数是次外层的2倍 |
| Z | 元素的主要合价为一2价 |
| M | 其单质及化合物的焰色反应呈黄色 |
| N | 与Y同主族,其单质为半导体 |
(1)X2Z的电子式是
 ;M2Z中所含化学键类型是离子键.
;M2Z中所含化学键类型是离子键.(2)Y的非金属性比N强(填“强”或“弱”),能证明此结论的事实是CO 2+H 2O+SiO32-=H 2SiO 3↓+CO 32-(用离子方程式表示).
(3)YX4的结构简式为CH4;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物最多有5种.
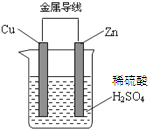
| A. | 锌片是正极 | |
| B. | 铜片上发生的反应为 Cu-2e-═Cu2+ | |
| C. | 电子由铜片通过导线流向锌片 | |
| D. | 该装置能够将化学能转化为电能 |
| A. | 一定有甲烷 | B. | 可能有丙烷 | C. | 一定有乙烯 | D. | 可能有丙炔 |
| A. | 同系物:CH2O2、C2H4O2、C3H6O2 | B. | 化合物:五水硫酸铜、烧碱、冰醋酸 | ||
| C. | 电解质:Al2O3、NaOH、CaCO3 | D. | 同素异形体:金刚石、石墨、足球烯 |
(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键
(3)根据第一电离能(数据见下表),最有可能生成稳定单核阳离子的卤素原子是I
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
则二者酸性相对强弱是HIO3>H5IO6(填“>”、“<”或“=”).
(5)已知ClO2-为V形结构,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3与ClO2-为等电子体的是Cl2O或OF2(写出其中一个的化学式)
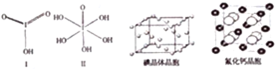
(6)关于碘晶体(晶体结构见上图)的以下说法中正确的是AD
A.2种取向不同排列的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(晶胞结构见上图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为$\frac{a{\;}^{3}ρN{\;}_{A}}{4}$.
| A. | 液氯、晶体硅、臭氧均属于单质 | B. | 盐酸、醋酸、苯酚均属于强电解质 | ||
| C. | CO2、CCl4、蛋白质均属于有机物 | D. | CuO、MgO、Na2O2均属于碱性氧化物 |