题目内容
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)===2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)===4NO(g)+6H2O(l) ΔH=c kJ·mol-1
反应8NH3(g)+6NO2(g)===7N2(g)+12H2O(l) ΔH=____kJ·mol-1。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
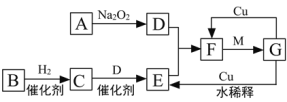
①用次氯酸钠除去氨氮的原理如图1所示。写出该图示的总反应化学方程式:______________________。该反应需控制温度,温度过高时氨氮去除率降低的原因是________________________________________________________________________。
 图1
图1 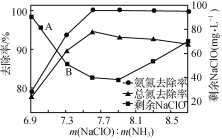 图2
图2

②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图2所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是____。
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图3所示。
①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
【答案】2c-7a-3b 2NH3+3NaClO===N2+3NaCl+3H2O 温度过高,HClO发生分解,氨氮去除率随之降低 增加NaClO的量,反应速率加快,相同时间内NaClO消耗多 有部分NH3被氧化成NO2-或NO3- 2NO3-+10H===N2↑+2OH-+4H2O 0.08
【解析】
(1)已知:①N2(g)+O2(g)===2NO(g) ΔH1=a kJ·mol-1
②2NO(g)+O2(g)===2NO2(g) ΔH2=b kJ·mol-1
③4NH3(g)+5O2(g)===4NO(g)+6H2O(l) ΔH3=c kJ·mol-1
根据盖斯定律,由③×2-②×3-①×7得反应8NH3(g)+6NO2(g)===7N2(g)+12H2O(l) ΔH=2ΔH3-3ΔH2-7ΔH1=(2c-7a-3b)kJ·mol-1;
(2)①用次氯酸钠除去氨氮的原理如图所示,次氯酸钠、氨气为反应物,次氯酸、盐酸、氢氧化钠均为中间产物,氯化钠、氮气和水为生成物,故该图示的总反应化学方程式为:2NH3+3NaClO=N2+3NaCl+3H2O;该反应需控制温度,温度过高时氨氮去除率降低的原因是温度过高,HClO发生分解,氨氮去除率随之降低;
②点B比点A m(NaClO)∶m(NH3)增大,增加NaClO的量,反应速率加快,相同时间内NaClO消耗多,故点B剩余NaClO含量低于点A;
当m(NaClO)∶m(NH3)>7.6时,有部分NH3被氧化成NO2-或NO3-,水体中总氮去除率反而下降;
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO![]() 还原为N2,工作原理如图所示:
还原为N2,工作原理如图所示:
①该活性原子H与NO3-反应生成氮气,反应的离子方程式为:2NO3-+10H=N2↑+2OH-+4H2O;
②若阳极生成标准状况下2.24 L气体,为氧气,转移电子的物质的量为![]() ,根据电荷守恒,根据NO3-转化为N2,理论上可除去NO3-的物质的量为
,根据电荷守恒,根据NO3-转化为N2,理论上可除去NO3-的物质的量为![]() mol。
mol。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案【题目】目前,燃煤脱硫是科研工作者研究的重要课题之一,主要脱硫方法有以下几种:
Ⅰ.石灰法原理为:2CaO(s)+2SO2(g)+O2(g)2CaSO4(s)
(1)T1℃时,向10L恒容密闭容器中加入3molCaO(s),并通入2molSO2(g)和1molO2(g)发生上述反应,2min时达平衡,此时CaSO4(s)为1.8mol。0~2min内,用SO2(g)表示的该反应的速率v(SO2)=__________________________。
Ⅱ.催化氧化法
活性炭催化氧化法是基于活性良好的物理吸附和化学吸附作用,其反应机理为:
O2+2C→2C—O;SO2+C→C—SO2;C—SO2+C—O→C—SO3+C;
C—SO3+H2O→C—H2SO4;C—H2SO4→H2SO4+C。
(2)整个过程中总的化学反应方程式为__________________________________________。
(3)活性炭在反应过程中作催化剂,改变了_____________(填选项字母)。
A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能
Ⅲ.CO还原法原理为2CO(g)+SO2(g)S(g)+2CO2(g) ΔH
已知:S(g)+O2(g)=SO2(g) ΔH1=-574.0kJ·mol-1;CO燃烧热为283.0kJ·mol-1。
(4)起始温度为T2℃时,分别在三个容积均为10L的绝热密闭容器中,发生反应2CO(g)+SO2(g)S(g)+2CO2(g),测得相关数据如下表所示。
容器 | 起始时物质的量/mol | 平衡时CO2(g)的物质的量/mol | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
甲 | 1 | 0.5 | 0.5 | 0 | A |
乙 | 1 | 0.5 | 0 | 0 | 0.8 |
丙 | 2 | 1 | 0 | 0 | b |
①容器乙达到平衡后,保持其他条件不变,再向其中充入CO(g)、 SO2(g)、S(g)、CO2(g)各1mol,此时v(正)__________ v(逆)。(填“>”、“<”或“=”)。
②下列判断正确的是________________(填选项字母)。
A.b=1.6 B.平衡常数甲>乙 C.达到平衡的时间:丙<乙
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应:2SO2(g)+ O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2mol SO2 1molO2 | 4mol SO3 | 2molSO2 1mol O2 |
平衡v正(SO2) mol/(L·s) | v1 | v2 | v3 |
平衡c(SO3) mol/L | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | a1(SO2) | a2(SO3) | a3(SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法不正确的是
A. v1< v2,c2< 2c1 B. v1< v3,α1(SO2 ) >α3(SO2 )
C. K1> K3,p2> 2p3 D. c2> 2c3,α2(SO3 )+α3(SO2 )<1