题目内容
4.常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A.根据题意回答下列问题:(1)写出酸H2A的电离方程式H2A?H++HA-、HA-?H++A2-.
(2)若溶液M由10mL 2mol•L-1NaHA溶液与2mol•L-1NaOH溶液等体积混合而得,则溶液M的pH>7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+).
已知Ksp(BaA)=1.8×10-10,向该混合溶液中加入10mL 1mol•L-1BaCl2溶液,混合后溶液中的Ba2+浓度为5.4×10-10 mol•L-1.
(3)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液$\frac{c({H}^{+})}{c(O{H}^{-})}$=104,V1与V2的大小关系为均有可能(填“大于”“等于”“小于”或“均有可能”).
分析 (1)存在的分子有H2O、H2A,则H2A为弱酸;
(2)等体积混合生成Na2A,水解显碱性,离子水解以第一步为主;由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=$\frac{0.01mol}{30×1{0}^{-3}L}$=$\frac{1}{3}$mol•L-1,根据BaA的Ksp可得c(Ba2+);
(3)混合溶液c(H+)/c(OH-)=104,c(H+)=10-5mol/L,显酸性,则酸过量,以此分析.
解答 解:(1)存在的分子有H2O、H2A,则H2A为弱酸,电离方程式为H2A?H++HA-、HA-?H++A2-,故答案为:H2A?H++HA-、HA-?H++A2-;
(2)等体积混合生成Na2A,水解显碱性,pH>7,离子水解以第一步为主,则离子浓度关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=$\frac{0.01mol}{30×1{0}^{-3}L}$=$\frac{1}{3}$mol•L-1,根据BaA的Ksp=c(Ba2+)•c(A2-)可得c(Ba2+)=$\frac{{K}_{sp}}{c({A}^{2-})}$=$\frac{\frac{1.8×1{0}^{-10}}{1}}{3}$
=5.4×10-10 mol•L-1;
故答案为:>;c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);5.4×10-10;
(3)混合溶液c(H+)/c(OH-)=104,c(H+)=10-5mol/L,显酸性,则酸过量,H2A为弱酸,pH=3的H2A溶液与pH=11的NaOH溶液混合时酸的浓度大于碱的浓度,则二者体积关系不确定,大于、小于或等于都可能酸过量,故答案为:均有可能.
点评 本题考查较综合,涉及酸碱混合的定性分析、pH、电离与水解、电离方程式等,把握溶液中的溶质及电离与水解的趋势、相互影响即可解答,题目难度中等.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 硒化氢比硫化氢稳定 | |
| B. | 原子序数为 34 | |
| C. | 最高价氧化物的水化物的分子式为:H2SeO4 | |
| D. | Se 的非金属性比 Br 弱 |
| A. | 生成白色沉淀 | B. | 生成红褐色沉淀 | C. | 生成灰绿色沉淀 | D. | 有气泡产生 |
| A. | 干冰和碘分别变为气体 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 二氧化硅和铁分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
①增大压强②升高温度③恒容通入CO2④增加碳的量⑤恒容通入N2.
| A. | ①②③⑤ | B. | ①②③④⑤ | C. | ①②③ | D. | ②③④ |
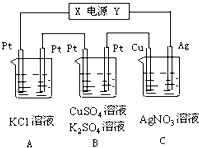 如图所示,若电解5min时铜电极的质量增加2.16g,B中一根Pt电极质量增加0.32g,且此时B中两极都有气体产生.试回答:
如图所示,若电解5min时铜电极的质量增加2.16g,B中一根Pt电极质量增加0.32g,且此时B中两极都有气体产生.试回答: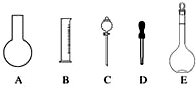 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: