题目内容
5.取116.6g的NH4Cl和(NH4)2CO3固体混合物,加水完全溶解后,加入过量的CaCl2溶液得到10g的白色沉淀,试计算固体混合物中NH4Cl的物质的量.分析 10g白色沉淀为CaCO3,根据碳酸根守恒可得:n[(NH4)2CO3]=n(CaCO3),根据m=nM计算m[(NH4)2CO3],再根据总质量计算出m(NH4Cl),最后根据n=$\frac{n}{M}$计算.
解答 解:10g白色沉淀为CaCO3,根据碳酸根守恒可得:n[(NH4)2CO3]=n(CaCO3)=$\frac{10g}{100g/mol}$=0.1mol,
故m(NH4Cl)=116.6g-0.1mol×96g/mol=107g,
则n(NH4Cl)=$\frac{107g}{43.5g/mol}$=2mol,
答:固体混合物中NH4Cl的物质的量为2mol.
点评 本题考查混合物的有关计算,注意利用守恒法解答,侧重对基础知识的巩固.

练习册系列答案
相关题目
15.下列属于吸热反应的是( )
| A. | Ba(OH)2•8H2O和NH4Cl(s)混合反应 | B. | 生石灰和水的反应 | ||
| C. | 液态水气化 | D. | 盐酸与氢氧化钠溶液的反应 |
16.下列各组物质中,不管它们以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳的量不变的是( )
| A. | 乙烷和苯 | B. | 乙醇和丙醇 | C. | 乙醇和乙醚 | D. | 甲醛和乙酸 |
13.下列各组物质中,具有相同的实验式,但不是同系物,也不是同分异构体的是( )
| A. | 苯和乙烯 | B. | 甲醛和甲酸甲酯 | C. | 乙酸和甲酸甲酯 | D. | 乙烯和苯乙烯 |
20.维生素A的结构简式如图所示,关于它的叙述中正确的是( )
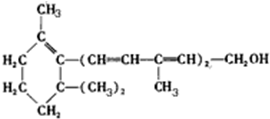

| A. | 维生素A属于环烃 | |
| B. | 维生素A不能与金属钠反应产生氢气 | |
| C. | 维生素A不能使酸性KMnO4溶液褪色 | |
| D. | 维生素A能发生取代、加成、酯化反应 |
17.下列叙述中,正确的是( )
| A. | 光导纤维广泛应用于现代通讯,制造光导纤维的主要原料是Si | |
| B. | 二氧化碳不宜用于扑灭金属钠燃烧引起的火灾 | |
| C. | 一定条件下,可将石墨转化为金刚石,这一变化是物理变化 | |
| D. | 氢气作为新型燃料,其突出的优点是氢气轻,便于携带 |
14.某烯烃与氢气加成后得到2,3-二甲基丁烷,则该烯烃的名称是( )
| A. | 2,3-二甲基-2-丁烯 | B. | 2,2-二甲基-3-丁烯 | ||
| C. | 2,2-二甲基-1-丁烯 | D. | 2,3-二甲基-1-丁烯 |