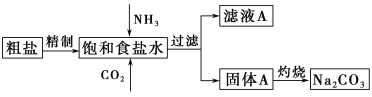
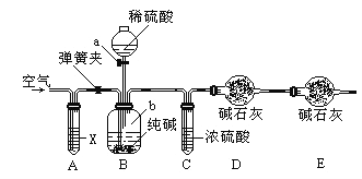
题目内容
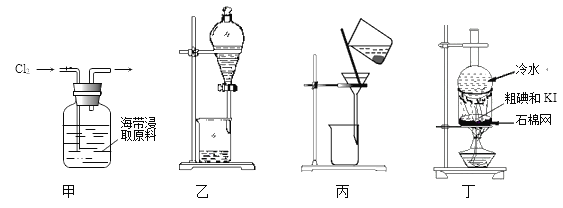
【题目】实验室用干海带浸取原液制取纯碘主要包含的步骤有:①通氯气氧化、②用CCl4萃取分液、③在CCl4相中加入NaOH溶液反萃取(转化为NaI和NaIO3)并分液、④水相用硫酸酸化分离出粗碘、
⑤干燥后加适量KI固体(将IBr和ICl转化为I2、KBr及KCl)混匀加热得纯碘等。选择下列装置进行实验:
下列说法错误的是
A. 步骤①可用甲装置氧化I-
B. 步骤②、③分液操作时可用乙装置:先放出有机相,再放出水相
C. 步骤④可用丙装置将碘与母液分离
D. 步骤⑤可用丁装置升华法提纯碘
【答案】B
【解析】
A、氯气与碘离子反应生成碘单质;
B、分液漏斗中液体下层由下口放出,上层液体由上口倒出。
C、分离液体与不溶于液体的固体,用过滤;
D、碘易升华;
A、氯气与碘离子反应生成碘单质,步骤①可用甲装置氧化I-,故A正确;
B、四氯化碳的密度比水大,故有机层在下层。分液时,下层液体由下口放出,上层液体由上口倒出,故B错误。
C、分离液体与不溶于液体的固体,用过滤,步骤④可用丙装置将碘与母液分离,故C正确;D、碘易升华,可用于提纯碘,故D正确;
故选B。

【题目】60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)的关系见下表.
m-n | 0 | 1 | 2 | 3 |
含氧酸强度 | 弱酸 | 中强 | 强 | 很强 |
实例 | HClO | H3PO4 | HNO3 | HClO4 |
试回答下列问题:
(1)按此规则判断碳酸应属于_____酸。
(2)按此规则判断H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为_______________。
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大.已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构__________________、________________________。