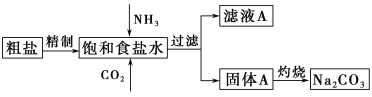
题目内容
【题目】理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)画出原电池装置图_______,该电池的负极发生_______反应(填“氧化”或“还原”),电解质溶液是_______;
(2)放电时银离子向__________(填“正极”或“负极”),正极上出现的现象是________。
(3)当反应进行一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了电子数目是___________。
【答案】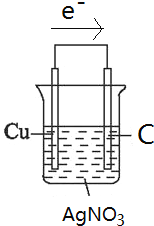 氧化 硝酸银 正极 有白色固体析出 0.05NA
氧化 硝酸银 正极 有白色固体析出 0.05NA
【解析】
(1)根据反应方程式知,Cu失电子发生氧化反应,Ag+得电子发生还原反应,选铜作负极材料、银(或石墨等)作正极材料,硝酸银溶液作电解质溶液,电子从负极经导线流向正极,该装置图为: ;该电池的负极发生氧化反应,电解质溶液是硝酸银溶液;
;该电池的负极发生氧化反应,电解质溶液是硝酸银溶液;
(2)放电时银离子向正极,正极上析出银单质,出现的现象是有白色固体析出;
(3)因为正极的电极反应式为:Ag++e-=Ag,所以测得某一电极增重了5.4g,即正极生成0.05molAg时转移电子数目是0.05NA。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案【题目】60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)的关系见下表.
m-n | 0 | 1 | 2 | 3 |
含氧酸强度 | 弱酸 | 中强 | 强 | 很强 |
实例 | HClO | H3PO4 | HNO3 | HClO4 |
试回答下列问题:
(1)按此规则判断碳酸应属于_____酸。
(2)按此规则判断H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为_______________。
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大.已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构__________________、________________________。