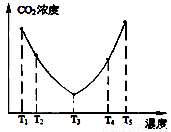题目内容
2.高纯氧化铝可用于制高压钠灯的陶瓷管.实验室制取高纯氧化铝的流程如下: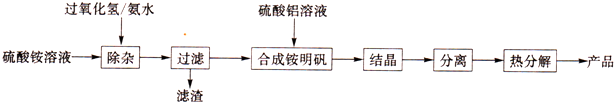
(1)“除杂”操作是加入适量过氧化氢,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+.检验Fe2+已除尽的实验操作是取少量除杂后的滤液,加适量H2O2溶液,振荡,滴加KSCN溶液,若无明显现象,说明Fe2+已除尽.
(2)通常条件下,KSP[Fe(OH)3]=4.0×10-38,除杂后溶液中c(Fe3+)=4.0×10-20mol/L.
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的是目的是抑制Al3+水解.
(4)“结晶”操作中,母液经蒸发浓缩至溶液表面刚出现薄层的结晶为止,冷却结晶,得到铵明矾(含结晶水).母液不能蒸干的原因是减少可溶性杂质的析出及Al3+水解.
(5)“分离”操作名称是c(填字母代号)a.蒸馏 b.分液 c.过滤
(6)测定铵明矾组成的方法是:
a.称取0.906g铵明矾样品,高温灼烧,得Al2O3残留固体0.102g;
b.称取0.906g铵明矾样品,用适量蒸馏水溶解,再加入稍过量的BaCl2溶液,经静置、过滤、洗净,得BaSO40.932g;
c.称取0.906g样品,加入足量的NaOH溶液,加热,产生气体依次通过碱石灰和浓硫酸,浓硫酸增重0.0340g.则铵明矾的化学式为NH4Al(SO4)2•12H2O.
(7)有同学认为,第(6)问测定铵明矾组成的方法a、b、c三个试验中,有一个实验不必实施也能推导出铵明矾的化学式,您认为合理吗?若合理,请在下列空格写出不必实施的实验代号(即填上a、b、c其中的一个);若不合理,则在下列空格填上“不合理”,你的结论是a或c.
分析 (1)取样,加适量H2O2溶液,滴加KSCN溶液,若无明显现象,说明Fe2+已除尽;
(2)根据氢氧化铁的溶度积及PH=8计算出铁离子浓度;
(3)铝离子在溶液中能够发生水解生成氢氧化铝;
(4)蒸干会析出可溶性杂质的析出,且Al3+水解程度增大;
(5)将晶体与溶液分离的操作是过滤;
(6)根据题中数据,计算出铝元素质量、硫酸根离子质量,再根据总质量计算出水的质量,最后计算出铵明矾的化学式;
(7)依据电荷守恒可以计算另一种离子物质的量分析.
解答 解:(1)检验Fe2+是否除尽的实验操作是:取少量除杂后的滤液,加适量H2O2溶液,振荡,滴加KSCN溶液,若无明显现象,说明Fe2+已除尽,
故答案为:取少量除杂后的滤液,加适量H2O2溶液,振荡,滴加KSCN溶液,若无明显现象,说明Fe2+已除尽;
(2)KSP[Fe(OH)3]=4.0×10-38,PH=8,溶液中氢氧根离子浓度为:1×10-6mol/L,c(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1×1{0}^{-6})^{3}}$mol/L=4.0×10-20mol/L,
故答案为:4.0×10-20mol/L;
(3)由于铝离子在溶液中能够发生水解生成氢氧化铝,所以加入硫酸酸化,抑制了铝离子的水解,
故答案为:抑制Al3+水解;
(4)由于蒸干会析出可溶性杂质的析出,且Al3+水解程度增大,所以母液不能蒸干,
故答案为:减少可溶性杂质的析出及Al3+水解;
(5)通过过滤,将硫酸铝晶体从溶液中分离,所以c正确;
故答案为:c;
(6)a.称取0.906g铵明矾样品,高温灼烧,得Al2O3残留固体0.1020g,氧化铝的物质的量为:$\frac{0.1020}{102}$mol=0.001mol,含有0.002mol铝离子,质量为0.054g
b.称取0.906g铵明矾样品,用适量蒸馏水溶解,再加入稍过量的BaCl2溶液,经陈化、过滤、灰化,得BaSO40.932g;硫酸钡的物质的量为:$\frac{0.932g}{233g/mol}$=0.004mol,含有硫酸根离子的物质的量为0.004mol,质量为0.384g,
c.称取0.906g样品,加入足量的NaOH溶液,加热,产生气体依次通过碱石灰和浓硫酸,浓硫酸增重0.0340g,浓硫酸增重的质量为氨气质量,氨气的物质的量为:$\frac{0.0340}{17}$mol=0.002mol,铵离子的物质的量为0.002mol,质量为0.036g,
0.906g样品中,含有水的质量为:0.906g-0.054-0.384-0.036=0.432g,水的物质的量为:$\frac{0.432g}{18g/mol}$mol=0.024mol,
n(NH4+):n(Al3+):n(SO42-)):n(H2O)=0.002:0.002:0.004:0.024=1:1:2:12,
所以铵明矾的化学式:NH4Al(SO4)2•12H2O
故答案为:NH4Al(SO4)2•12H2O;
(7)第(6)问测定铵明矾组成的方法a、b、c三个试验中,有一个实验不必实施也能推导出铵明矾的化学式,合理,铵根离子和氯离子只需测定一种,按照电荷守恒计算另一种阳离子的物质的量,所以合理,填a或c,
故答案为:a或c.
点评 本题考查工艺流程、离子检验、盐类水解、对条件的控制选择、物质的分离提纯等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下(已知2SO2(g)+O2(g)  2SO3(g)ΔH=-196.6 kJ·mol-1)。
2SO3(g)ΔH=-196.6 kJ·mol-1)。
容器 | 甲 | 乙 | 丙 | 丁 |
起始投料量 | 2molSO2 1mol O2 | 1 mol SO2 0.5mol O2 | 2mol SO3 | 2mol SO2 2mol O2 |
反应放出或吸收的热量(kJ) | a | b | c | d |
平衡时c(SO3) (mol·L-1) | e | f | g | h |
下列关系正确的是( )
A.a=c;e=g B.a>2b;e>2f C.a>d;e>h D.c+98.3e>196.6
在温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:
CH4(g)+2NO2(g) N2(
N2( g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是
A.T1>T2,且a>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol
D.温度为T1时,达平衡时CH4 的转化率大于NO2的转化率
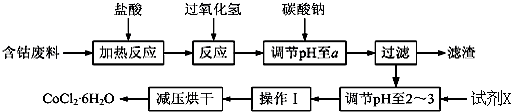
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐(写两点).
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;pH调至a后过滤,再用试剂X将滤液的pH调节至2-3,则所用的试剂X为盐酸.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2•6H2O的质量分数大于100%,其原因可能是样品中含有NaCl杂质,CoCl2•6H2O烘干时失去了部分结晶水(写出两个原因).
(6)在实验室中,为了从上述产品中获得纯净的CoCl2•6H2O,常将制得的产品溶解于乙醚中,然后过滤、蒸馏(填实验操作)获得纯净的CoCl2•6H2O.
| A. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 分子式为C3H7Cl的同分异构体共有2种 | |
| D. | 谷氨酸分子(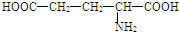 )间缩合可形成二肽 )间缩合可形成二肽 |
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
 J?mol—1
J?mol—1 的一个课题,污染分为空气污染,水污染,土壤污染等。
的一个课题,污染分为空气污染,水污染,土壤污染等。 ,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图
,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图