题目内容
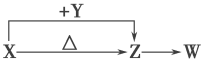
【题目】X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如下图转化关系(部分反应物、产物及反应条件已略去)。请回答:
(1)Y的电子式是____________________。
(2)X与Y在溶液中反应的离子方程式是__________________________________________。
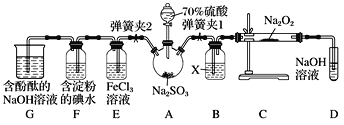
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
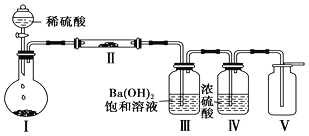
①装置Ⅰ中反应的化学方程式是_________________________________________________,装置Ⅱ中反应的化学方程式是________________________________________________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是___________,所需仪器装置是_______________。 (从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是__________________________________________________。
【答案】![]() HCO3—+OH-== CO32—+H2O Na2CO3+H2SO4 ==Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4==Na2SO4+2CO2↑+2H2O 2Na2O2+2CO2 == 2Na2CO3+O2 H2O2 Ⅰ、Ⅳ、Ⅴ 2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3
HCO3—+OH-== CO32—+H2O Na2CO3+H2SO4 ==Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4==Na2SO4+2CO2↑+2H2O 2Na2O2+2CO2 == 2Na2CO3+O2 H2O2 Ⅰ、Ⅳ、Ⅴ 2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3
【解析】
X、Y、Z的焰色反应均为黄色,说明三者均为钠元素的化合物.X含有四种元素,在加热条件下能生成Z,这四种化合物均为短周期元素组成,且W为无色无味的气体,可推出X是NaHCO3,则Z是Na2CO,W是CO2,Y是NaOH。
(1)NaOH属于离子化合物,据此写出其电子式;
(2)氢氧化钠与碳酸氢钠反应生成碳酸钠与水,据此写出其离子方程式;
(3)①X所含的四种元素为:Na、H、C、O,利用元素之间组成的化合物,制备并收集纯净干燥的无色气体R.R由组成X的四种元素中的一种组成,为气体单质,装置Ⅲ中产生白色沉淀,则装置Ⅰ中反应生成二氧化碳,在装置Ⅱ中反应生成气体单质R,应为二氧化碳与过氧化钠反应生成氧气,装置Ⅲ除去氧气中混有的二氧化碳,装置Ⅳ为干燥氧气,装置Ⅴ中收集的气体是氧气;据此进行分析;
②装置Ⅴ中收集的气体是氧气,氧气的制取也可以用双氧水和二氧化锰;将装置Ⅱ、Ⅲ去掉,分液漏斗中盛放过氧化氢,圆底烧瓶内盛放二氧化锰,据此分析。
(4)碳酸钠溶液和氯气反应生成的具有漂白、消毒作用的物质是 NaClO,还有碳酸氢钠、氯化钠,据此写出反应方程式。
X、Y、Z的焰色反应均为黄色,说明三者均为钠元素的化合物.X含有四种元素,在加热条件下能生成Z,这四种化合物均为短周期元素组成,且W为无色无味的气体,可推出X是NaHCO3,则Z是Na2CO,W是CO2,Y是NaOH。
(1)结合以上分析可知,NaOH属于离子化合物,电子式是![]() ;
;
综上所述,本题答案是:![]() 。
。
(2)碳酸氢钠与氢氧化钠溶液反应生成碳酸钠和水,离子方程式是:HCO3—+OH-== CO32—+H2O;
综上所述,本题答案是:HCO3—+OH-== CO32—+H2O。
(3) ①X所含的四种元素为:Na、H、C、O,利用元素之间组成的化合物,制备并收集纯净干燥的无色气体R.R由组成X的四种元素中的一种组成,为气体单质,装置Ⅲ中产生白色沉淀,则装置Ⅰ中反应生成二氧化碳,在装置Ⅱ中反应生成气体单质R,应为二氧化碳与过氧化钠反应生成氧气,装置Ⅲ除去氧气中混有的二氧化碳,装置Ⅳ为干燥氧气,装置Ⅴ中收集的气体是氧气;因此装置Ⅰ中的固体反应物是碳酸钠或碳酸氢钠,因此装置Ⅰ中发生的反应是: Na2CO3+H2SO4 ==Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4==Na2SO4+2CO2↑+2H2O;二氧化碳和过氧化钠反应生成氧气,饱和氢氧化钡溶液可除去二氧化碳,通过浓硫酸干燥后得到纯净的氧气,因此装置Ⅱ中物质的化学式是Na2O2;反应的方程式为:2Na2O2+2CO2 == 2Na2CO3+O2;
综上所述,本题答案是:Na2CO3+H2SO4 ==Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4==Na2SO4+2CO2↑+2H2O ;2Na2O2+2CO2 == 2Na2CO3+O2 。
②因为过氧化氢在二氧化锰等作催化剂的情况下,可以分解产生氧气,其反应装置需要Ⅰ(气体发生装置)、Ⅳ(干燥装置)、Ⅴ(收集装置);
综上所述,本题答案是:H2O2 ,Ⅰ、Ⅳ、Ⅴ。
(4) Z溶液是碳酸钠溶液,其和氯气反应生成的具有漂白、消毒作用的物质是 NaClO,除此以外,还有碳酸氢钠和氯化钠,因此该反应方程式为:2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3;
综上所述,本题答案是:2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备及 A 中酒精灯已略)。
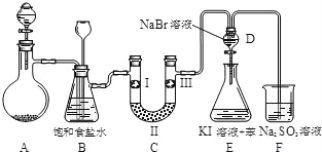
(1)实验室制氯气的离子方程式为_____。
(2)装置 B 中饱和食盐水的作用是_____;请写出装置 B 的另一个作用_______________________________。
(3)装置 C 的实验目的是验证氯气是否具有漂白性, 为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是_______________(填编号)。
编号 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置 D、E 的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置 D 中少量溶液加入装置 E 中,振荡,静置,观察到的现象是_____,该现象不能说明溴的非金属性强于碘,原因是_________。
(5)装置 F 中所发生的离子反应方程式:_____。