题目内容
【题目】某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:

(1)酸溶及后续过程中均需保持算过量,其目的除了提高铁元素的浸出率之外,还有___________。
(2)操作Ⅰ名称是_______________。
(3)滴加H2O2溶液氧化时,发生主要反应的离子方程式为_________________。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:_______________________。
(5)加入过量NaOH溶液的目的是__________________。
(6)请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体______,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。
【答案】抑制Fe3+水解过滤H2O2+2Fe2++2H+=2Fe3++2H2O取少许氧化后的溶液于试管中,向试管中滴加1-2滴酸性高锰酸钾溶液,紫色不褪去,说明铁元素全部以Fe3+形式存在将Al3+转化为AlO2-,分离Fe3+与Al3+加入稀盐酸使固体完全溶解,在氯化氢氛围内蒸发浓缩、冷却结晶,过滤
【解析】试题分析:分析题给工艺流程知向菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)加硫酸溶液酸溶,发生反应:FeCO3+2H+== Fe2+ + H2O+CO2↑、Al2O3 + 6H+==2Al3+ + 3H2O,经操作Ⅰ 过滤,滤液为硫酸亚铁和硫酸铝的混合液,向滤液中加入H2O2溶液,发生反应:2Fe2+ + H2O2 + 2H+==2Fe3+ + 2H2O,然后再加入过量NaOH溶液发生反应:Fe3+ + 3OH- == Fe(OH)3↓、Al3+ + 4OH-==AlO2- + 2H2O,将Fe3+和Al3+分离,过滤的氢氧化铁沉淀,向过滤后所得固体加入稀盐酸使固体完全溶解,在氯化氢氛围内蒸发浓缩、冷却结晶,过滤,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。
(1)酸溶及后续过程中均需保持酸过量,其目的除了提高铁元素的浸出率之外,还有抑制Fe3+水解。
(2)操作Ⅰ名称是过滤。
(3)滴加H2O2溶液氧化时,发生主要反应的离子方程式为2Fe2+ + H2O2 + 2H+==2Fe3+ + 2H2O 。
(4)在氧化过程中,检验铁元素全部以Fe3+形式存在的实验方案为取少许氧化后的溶液于试管中,向试管中滴加1-2滴酸性高锰酸钾溶液,紫色不褪去,说明铁元素全部以Fe3+形式存在。
(5)加入过量NaOH溶液的目的是将Al3+转化为AlO2-,分离Fe3+与Al3+。
(6)由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体加入稀盐酸使固体完全溶解,在氯化氢氛围内蒸发浓缩、冷却结晶,过滤,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。

 名校课堂系列答案
名校课堂系列答案【题目】用下图所示装置进行下列实验,实验结果与预测的现象不一致的是
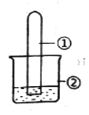
选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
A | NO2 | 蒸馏水 | 试管充满无色溶液 |
B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
C | NH3 | AlCl3溶液 | 产生白色沉淀 |
D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
A. A B. B C. C D. D