题目内容
19.如图1所示,将封闭的甲烷和氯气混合气体(体积比为1:4)的装置放置在光亮的地方,让混合气体充分反应.(1)使用饱和食盐水封闭混合气体的原因是氯气以及甲烷都不溶于饱和食盐水中.
(2)若两种气体恰好完全反应且只生成一种有机物,则反应的化学方程式为CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl;
(3)经过几小时的反应后,U形管右管中液面的变化是B(填字母)
A升高 B将低 C不变 D无法确定
(4)已知CH4分子呈正四面体形状,如图2所示为一个立方体,已画出1个C原子,1个H原子和1个共价键(实线表示),请画出另外3个H原子的合适位置和3条共价键.

分析 (1)根据氯气以及甲烷的水溶性来回答;
(2)根据甲烷和氯气发生取代反应的实质来回答判断;
(3)根据大气压强原理来判断U型管右端的玻璃管中水柱变化;
(4)甲烷是正四面体结构,碳原子位于四面体的正中心,四个氢原子位于四面体的四个顶点,据此回答判断.
解答 解:(1)氯气以及甲烷都不溶于饱和食盐水中,使用饱和食盐水封闭混合气体,可以便于观察甲烷和氯气之间的反应情况,故答案为:氯气以及甲烷都不溶于饱和食盐水中;
(2)甲烷中的氢原子可以被氯原子取代,甲烷与氯气反应充分,且只产生一种有机物即四氯化碳的化学方程式为:CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl,
故答案为:CH4+4Cl2$\stackrel{光照}{→}$CCl4+4HCl;
(3)经过几个小时的反应后,消耗氯气,反应中气体的物质的量减少,所以压强减小,且生成的HCl能够溶解于水,U型管右端的玻璃管中水柱降低,故答案为:B;
(4)由于碳原子在正方体中心,一个氢原子在顶点,因为碳氢键是等长的,那么另三个氢原子也应在正方体的顶点上,正方体余下的七个顶点可分成三类,三个为棱的对侧,三个为面对角线的对侧,一个为体对角线的对侧.显然三个在面对角线对侧上的顶点为另三个氢原子的位置,即由于碳原子在正方体中心,一个氢原子在顶
点,
因为碳氢键是等长的,
那么另三个氢原子也应在正方体的顶点上,
正方体余下的七个顶点可分成三类,
三个为棱的对侧,
三个为面对角线的对侧,
一个为体对角线的对侧.
显然三个在面对角线对侧上的顶点为另三个氢原子的位置 ,故答案为:
,故答案为: .
.
点评 本题考查了甲烷的性质,注意甲烷和氯气发生取代生成一系列取代产物,分析现象时抓住生成物的性质特征.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
7.(1)人们常用催化剂来选择反应进行的方向.如图1所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
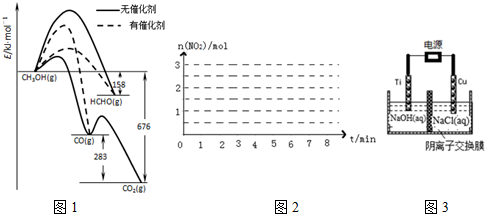
①写出1moL HCHO生成CO的热化学方程式:HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)△H=-235KJ•mol-1.
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能.
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10L定容容器中发生反应2N2H4(g)+2NO2(g)?3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是abd.
a.混合气体密度保持不变
b.3v正(NO2)=2v逆(N2)
c.N2H4与NO2体积比保持不变
d.体系压强保持不变
②在某温度下,5L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
请画出该反应中n(NO2)随时间变化曲线,并画出在第7min分别升温、加压、加催化剂的情况下n(NO2)随时间变化示意图如图2.计算该温度下反应的平衡常数K(保留2位有效数字,写出计算过程).
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
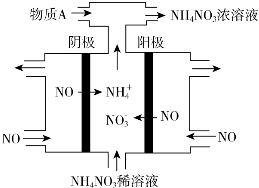
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑,如图3所示.该电解池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.

①写出1moL HCHO生成CO的热化学方程式:HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)△H=-235KJ•mol-1.
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能.
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10L定容容器中发生反应2N2H4(g)+2NO2(g)?3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是abd.
a.混合气体密度保持不变
b.3v正(NO2)=2v逆(N2)
c.N2H4与NO2体积比保持不变
d.体系压强保持不变
②在某温度下,5L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/mol 时间 | n (N2H4) | n (NO2) | n (N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑,如图3所示.该电解池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
14. 某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
①取少量该溶液加NaOH溶液共热,产生刺激性气味的气体,未观察到其它明显现象;
②另取少量该溶液加足量的硝酸,可观察到红棕色气体,未观察到沉淀生成.
根据上述实验,以下说法正确的是( )
 某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:①取少量该溶液加NaOH溶液共热,产生刺激性气味的气体,未观察到其它明显现象;
②另取少量该溶液加足量的硝酸,可观察到红棕色气体,未观察到沉淀生成.
根据上述实验,以下说法正确的是( )
| A. | 由实验①只能确定原溶液中一定有NH4+,没有Fe2+. | |
| B. | 取实验②后的溶液滴加淀粉溶液,可能变蓝色. | |
| C. | 原溶液中可能含有NH4+、Na+、SO32-、I-四种离子 | |
| D. | 取少量原溶液加酸性高锰酸钾溶液,可能有两种离子被氧化 |
6.醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,下列叙述正确的是( )
| A. | CH3COOH溶液中加少量的CH3COONa固体,平衡正向移动 | |
| B. | 0.10 mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 | |
| C. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后溶液的pH>7 |
3.常温下,下列有关溶液的叙述正确的是( )
| A. | 将PH=1的醋酸和PH=13的Na OH溶液混合后,若c(CH3COO-)=c(Na+),则溶液显中性 | |
| B. | 在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-) | |
| C. | pH=6的CH3COOH溶液和pH=6的NH4Cl溶液,由水电离出的c(H+)均为1×10-8mol•L-1 | |
| D. | 在饱和Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
4.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4 LSO3所含电子数约为40 NA | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 92 g NO2、N2O4混合气体含有的N原子数为2NA | |
| D. | 1 mol Cl2作为氧化剂得到的电子数为NA |