��Ŀ����
 ������������Ƭ����Ч�ɷ֣�ClO2����һ�ָ�Ч����ȫ��ɱ������������
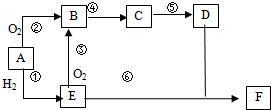
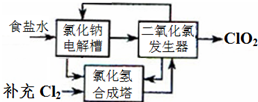
������������Ƭ����Ч�ɷ֣�ClO2����һ�ָ�Ч����ȫ��ɱ��������������1������һ���Ȼ��Ƶ�ⷨ��һ�ֿɿ��Ĺ�ҵ����ClO2����ķ������÷�����ԭ����ͼ��������ǽ�ʳ��ˮ���ض������µ��õ��������ƣ�NaClO3�������ᷴӦ����ClO2��
�ٹ����п����õĵ�����
�ڴ˷���ȱ����Ҫ��
��2�����������������ѧ�����о�����һ���µ��Ʊ���������ά�ػ�ԭ����ClO2����ԭ���ǣ���ά��ˮ��õ������ղ���X��NaClO3��Ӧ����ClO2��
����ƽ����ʽ��
������Ӧ�в���4.48L������ɱ�״���£����壬����ת��
��ClO2��Cl2���ܽ���Ʒ�ˮ�е�CN-����Ϊ�������ʣ���������ԭΪCl-��������CN-��ͬ���ĵ�Ʒ�ˮ������Cl2�����ʵ�����ClO2��
��3����������ʵ���ҳ��������ƣ�NaClO3�����������ƣ�Na2SO3���������ữ�������Ʊ��������ȣ���ѧ��Ӧ����ʽΪ��2NaClO3+Na2SO3+H2SO4
| �� |
�ٷ�Ӧ�е�Na2SO3��Һ�д�������ƽ�⣺H2O?H++OH-��
�ڳ����£�0.1mol/L����Һ������Ũ���ɴ�С����
�۳����£���֪NaHSO3��Һ�����ԣ���Na2SO3��Һ�еμ�ϡ����������ʱ�����ʵ���Ҫ�ɷ���
���㣺���ԭ��,������ԭ��Ӧ����ʽ����ƽ,�ȡ��塢�⼰�仯������ۺ�Ӧ��
ר�⣺�����������������,Ԫ�ؼ��仯����
��������1���ٵ�ⱥ��ʳ��ˮ����H2��Cl2��NaOH���ʿ������õĵ���ΪH2��Cl2���ϳ�HCl����������ͼ��֪��������ΪNaClO3��HCl������ClO2������д������ʽ�����û��ϼ���������ƽ�õ���
�����ɵ������г����ж������Ȼ��д��������������ʵͣ��ѷ��룬���Ҽ��п�����ɴ�����Ⱦ���õ��ķ������ܴ�
��2������ά��Ϊ���ǣ�ˮ�����ղ���Ϊ�����ǣ�C6H12O6�������л�ԭ�ԣ��ɽ�NaClO3��ԭ�õ�ClO2��Cl��+5��+4�ۣ�����1�ۣ������ǣ�C6H12O6��C����Ϊ0����+4�ۣ�����4�ۣ�Ȼ����ƽ�õ���
���ɢٿ�֪����24molClO2��6mol CO2����ת��24mol�ĵ��ӣ�
��ÿĦ��Cl2�õ�2mol���ӣ���ÿĦ��ClO2�õ�5mol���ӣ���Ϊ2.5����
��3���ٴ��������ˮ�ĵ���ƽ��������ӵ�ˮ��ƽ�⣮
�ڲ�ˮ��Ķ�Ԫ������Ũ�����ˮ�������ģ��������Ӻ͵�һ��ˮ������������ӣ��������ӣ�
��Na2SO3��Һ�еμ�ϡ���ᣬ���߷�Ӧ��Ҫʹ��Һ�����ԣ�ֻ���Dz��ַ�Ӧ����������ΪNa2SO3��NaHSO3��NaCl��
�����ɵ������г����ж������Ȼ��д��������������ʵͣ��ѷ��룬���Ҽ��п�����ɴ�����Ⱦ���õ��ķ������ܴ�
��2������ά��Ϊ���ǣ�ˮ�����ղ���Ϊ�����ǣ�C6H12O6�������л�ԭ�ԣ��ɽ�NaClO3��ԭ�õ�ClO2��Cl��+5��+4�ۣ�����1�ۣ������ǣ�C6H12O6��C����Ϊ0����+4�ۣ�����4�ۣ�Ȼ����ƽ�õ���
���ɢٿ�֪����24molClO2��6mol CO2����ת��24mol�ĵ��ӣ�
��ÿĦ��Cl2�õ�2mol���ӣ���ÿĦ��ClO2�õ�5mol���ӣ���Ϊ2.5����
��3���ٴ��������ˮ�ĵ���ƽ��������ӵ�ˮ��ƽ�⣮
�ڲ�ˮ��Ķ�Ԫ������Ũ�����ˮ�������ģ��������Ӻ͵�һ��ˮ������������ӣ��������ӣ�
��Na2SO3��Һ�еμ�ϡ���ᣬ���߷�Ӧ��Ҫʹ��Һ�����ԣ�ֻ���Dz��ַ�Ӧ����������ΪNa2SO3��NaHSO3��NaCl��
���
�⣺��1���ٵ�ⱥ��ʳ��ˮ����H2��Cl2��NaOH���ʿ������õĵ���ΪH2��Cl2���ϳ�HCl����������ͼ��֪��������ΪNaClO3��HCl������ClO2������������ԭ��Ӧ��NaClO3����ԭ����ClO2��HCl����������Cl2��ͬʱ����ˮ����Ӧ�Ļ�ѧ����ʽΪ2NaClO3+4HCl=2ClO2��+Cl2��+2NaCl+2H2O��
�ʴ�Ϊ��H2��Cl2��2NaClO3+4HCl=2ClO2��+Cl2��+2NaCl+2H2O��
�����ɵ������г����ж������Ȼ��д��������������ʵͣ��ѷ��룬���Ҽ��п�����ɴ�����Ⱦ���õ��ķ������ܴʴ�Ϊ��ͬʱ�����˴������������������ʵͣ����Ҳ�Ʒ���Է��룬ͬʱ���п�����ɻ�����Ⱦ���õ��ķ������ܴ�
��2������ά��Ϊ���ǣ�ˮ�����ղ���Ϊ�����ǣ�C6H12O6�������л�ԭ�ԣ��ɽ�NaClO3��ԭ�õ�ClO2��Cl��+5��+4�ۣ�����1�ۣ������ǣ�C6H12O6��C����Ϊ0����+4�ۣ�����4�ۣ�����ƽ��Ļ�ѧ����ʽΪ1 C6H12O6+24 NaClO3+12H2SO4=24 ClO2��+6 CO2��+18H2O+12 Na2SO4��
�ʴ�Ϊ��1��C6H12O6��24��6��12��Na2SO4��
��30mol�����填24mole-
30��22.4L 24mol
4.48L 0.16mol
����ת�Ƶ�����Ϊ0.16NA���ʴ�Ϊ��0.16NA��
��ÿĦ��Cl2�õ�2mol���ӣ���ÿĦ��ClO2�õ�5mol���ӣ�������Cl2�����ʵ�����ClO2��2.5�����ʴ�Ϊ��2.5��
��3���ٴ��������ˮ�ĵ���ƽ��������ӵ�ˮ��ƽ�⣬SO32-+H2O?HSO3-+OH-���ʴ�Ϊ��SO32-+H2O?HSO3-+OH-��
�ڲ�ˮ��Ķ�Ԫ������Ũ�����ˮ�������ģ��������Ӻ͵�һ��ˮ������������ӣ��������ӣ����������ɴ�С����Ϊc��Na+����c��SO32-����c��OH-����c��HSO3-����c��H+�����ʴ�Ϊ��c��Na+����c��SO32-����c��OH-����c��HSO3-����c��H+����
��Na2SO3��Һ�еμ�ϡ���ᣬ���߷�Ӧ��Ҫʹ��Һ�����ԣ�ֻ���Dz��ַ�Ӧ����������ΪNa2SO3��NaHSO3��NaCl���ʴ�Ϊ��Na2SO3��NaHSO3��NaCl��
�ʴ�Ϊ��H2��Cl2��2NaClO3+4HCl=2ClO2��+Cl2��+2NaCl+2H2O��
�����ɵ������г����ж������Ȼ��д��������������ʵͣ��ѷ��룬���Ҽ��п�����ɴ�����Ⱦ���õ��ķ������ܴʴ�Ϊ��ͬʱ�����˴������������������ʵͣ����Ҳ�Ʒ���Է��룬ͬʱ���п�����ɻ�����Ⱦ���õ��ķ������ܴ�
��2������ά��Ϊ���ǣ�ˮ�����ղ���Ϊ�����ǣ�C6H12O6�������л�ԭ�ԣ��ɽ�NaClO3��ԭ�õ�ClO2��Cl��+5��+4�ۣ�����1�ۣ������ǣ�C6H12O6��C����Ϊ0����+4�ۣ�����4�ۣ�����ƽ��Ļ�ѧ����ʽΪ1 C6H12O6+24 NaClO3+12H2SO4=24 ClO2��+6 CO2��+18H2O+12 Na2SO4��
�ʴ�Ϊ��1��C6H12O6��24��6��12��Na2SO4��
��30mol�����填24mole-
30��22.4L 24mol
4.48L 0.16mol
����ת�Ƶ�����Ϊ0.16NA���ʴ�Ϊ��0.16NA��
��ÿĦ��Cl2�õ�2mol���ӣ���ÿĦ��ClO2�õ�5mol���ӣ�������Cl2�����ʵ�����ClO2��2.5�����ʴ�Ϊ��2.5��
��3���ٴ��������ˮ�ĵ���ƽ��������ӵ�ˮ��ƽ�⣬SO32-+H2O?HSO3-+OH-���ʴ�Ϊ��SO32-+H2O?HSO3-+OH-��
�ڲ�ˮ��Ķ�Ԫ������Ũ�����ˮ�������ģ��������Ӻ͵�һ��ˮ������������ӣ��������ӣ����������ɴ�С����Ϊc��Na+����c��SO32-����c��OH-����c��HSO3-����c��H+�����ʴ�Ϊ��c��Na+����c��SO32-����c��OH-����c��HSO3-����c��H+����
��Na2SO3��Һ�еμ�ϡ���ᣬ���߷�Ӧ��Ҫʹ��Һ�����ԣ�ֻ���Dz��ַ�Ӧ����������ΪNa2SO3��NaHSO3��NaCl���ʴ�Ϊ��Na2SO3��NaHSO3��NaCl��
���������⿼�黯ѧ�������̣��漰������ԭ��Ӧ��ظ����ƽ�����㣬��ѧʵ��������������ӣ������֪ʶ����Ŀ�Ѷ��еȣ�ע��������ʵķ��롢�ᴿ����������

��ϰ��ϵ�д�
 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д� Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
�����Ŀ
���ܱ�������һ����������巢����Ӧ��x A��g��+y B��g��?z C��g����ƽ��ʱ���A��Ũ��Ϊ0.5mol/L�������¶Ȳ��䣬���������ݻ�ѹ����ԭ����
���ٴ�ƽ��ʱ���A��Ũ��Ϊ0.8mol/L�������ж���ȷ���ǣ�������
| 1 |
| 2 |
| A��x+y��z |
| B��ƽ��������Ӧ�����ƶ� |
| C��B�����ʵ������� |
| D��C������������ֲ��� |
���ڸ��ֽⷴӦ��X+Y��Z+W������������ȷ���ǣ�������
| A����Z��ǿ�ᣬ��X��Y����һ����ǿ�� |
| B����X��ǿ�ᣬY���Σ���Ӧ�������ǿ����������� |
| C����Y��ǿ�X���Σ���Z��W����һ�������� |
| D����W�����Z���Σ���X��Y����һ����ǿ�� |

 ij�л���X�ķ��ӽṹ��ͼ��ʾ����ش��������⣺
ij�л���X�ķ��ӽṹ��ͼ��ʾ����ش��������⣺