题目内容
在密闭容器中一定量混合气体发生反应:x A(g)+y B(g)?z C(g),平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积压缩到原来的
,再达平衡时测得A的浓度为0.8mol/L,下列判断正确的是( )
| 1 |
| 2 |
| A、x+y<z |
| B、平衡向正反应方向移动 |
| C、B的物质的量增大 |
| D、C的体积分数保持不变 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:平衡时测得A的浓度为0.5mol/L,保持温度不变将容器的容积缩小到原来的一半,如平衡不移动,则A的浓度应增大为1.0mol/L,而此时为0.8mol/L,则说明增大压强平衡向正方向移动,以此进行判断.
解答:
解:平衡时测得A的浓度为0.5mol/L,保持温度不变将容器的容积缩小到原来的一半,如平衡不移动,则A的浓度应增大为1.0mol/L,而此时为0.8mol/L,则说明增大压强平衡向正方向移动,
A、增大压强平衡向正方向移动,说明反应物气体的计量数之和大于生成物气体的计量数,应为x+y>z,故A错误;
B、由以上分析可知平衡向正反应方向移动,故B正确;
C、平衡向正方向移动,B的转化率增大,物质的量减小,故C错误;
D、平衡向正方向移动,C的体积分数增大,故D错误;
故选:B.
A、增大压强平衡向正方向移动,说明反应物气体的计量数之和大于生成物气体的计量数,应为x+y>z,故A错误;
B、由以上分析可知平衡向正反应方向移动,故B正确;
C、平衡向正方向移动,B的转化率增大,物质的量减小,故C错误;
D、平衡向正方向移动,C的体积分数增大,故D错误;
故选:B.
点评:本题考查化学平衡移动知识,题目难度不大,注意从浓度的变化的角度判断平衡移动的方向,结合压强对平衡移动的影响分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,与浓硫酸能反应.可说明Cl比S得电子能力强的是( )
| A、全部 | B、②③④ |
| C、①②④ | D、除①以外 |
能表示阿伏加德罗常数数值的是( )
| A、23g钠在氧气中完全燃烧失电子数为0.5NA |
| B、标准状况下,22.4L苯所含的分子数 |
| C、室温下,8g甲烷含有共价键数为2NA |
| D、1L 1mol?L-1硫酸溶液所含的H+为NA |
下列说法中不正确的是( )
| A、能使澄清的石灰水变浑浊的气体可能是SO2 |
| B、能使品红溶液褪色将其煮沸溶液又变红的无色气体一定是SO2 |
| C、某强酸性溶液经分析其中含有大量的S2-,SO32- |
| D、用NaHSO3,Na2SO3与浓硫酸反应都可产生SO2 |
下列各组物质相互反应时,产生的气体能燃烧的是( )
| A、碳化钙[CaC2]投入水中 |
| B、炽热的焦炭投入浓硝酸中 |
| C、少量的二氧化锰加入双氧水中 |
| D、乙醇和浓硫酸共热至170℃ |
加入氢氧化钡溶液共热,有气体放出又有不溶于稀硝酸的白色沉淀生成的是( )
| A、硝酸钾溶液 |
| B、硝酸铵溶液 |
| C、硫酸铵溶液 |
| D、硫酸钠溶液 |
联合国确定2014年“世界水日”的宣传主题是“水与能源”(Water and Energy).水利部确定2014年我国纪念“世界水日”和“中国水周”活动的宣传主题为“加强河湖管理,建设水生态文明”,下列有关说法或做法不符合这一主题的是( )
| A、科学使用农药、化肥,减少水体污染 |
| B、工业废水和城市生活污水需净化处理,坚持达标排放 |
| C、为了节约生产成本,可将造纸厂、化工厂建在水源地上游 |
| D、合理开发水资源,建立水资源节约型和环境友好型经济 |
有德国重离子研究中心人工合成的第112号元素的正式名称为“Copernicium”,相应的元素符号位“Cn”.该元素的名称是为了纪念天文学家哥白尼而得名.该中心人工合成Cn的过程可表示为:
Zn+
Pb═
Cn+
n下列叙述中正确的是( )
70 30 |
208 82 |
277 112 |
1 0 |
| A、上述合成过程中属于化学变化 | ||
| B、Cn元素的相对原子质量为277 | ||
C、
| ||
| D、Cn元素位于元素周期表的第六周期,是副族元素 |
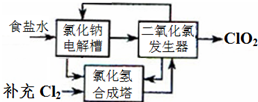 二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.