题目内容
 某有机物X的分子结构如图所示,请回答下列问题:
某有机物X的分子结构如图所示,请回答下列问题:(1)有机物X属于
A.烷烃 B.环烷烃 C.芳香烃 D.不饱和烃
(2)有机物X不具有的性质是
A.常温常压下呈气态 B.难溶于水,易溶于有机溶剂
C.能使溴的四氯化碳溶液褪色 D.能使KMnO4酸性溶液褪色
(3)X与足量的H2在一定条件下反应生成有机物Y,则Y的二氯代物有
(4)有机物Z、W分别是X的同分异构体,其中Z是一种芳香烃,W既不能使溴水褪色,也不能使KMnO4酸性溶液褪色,且W的一氯代物只有一种.
①写出W的结构简式
②Z与乙烯在一定条件下发生等物质的量聚合反应生成高分子化合物,写出其反应的化学方程式
考点:有机物的结构和性质,同分异构现象和同分异构体
专题:同分异构体的类型及其判定,有机物的化学性质及推断
分析:X为不饱和烃,含有碳碳双键,可发生加成反应,与氢气发生加成反应的产物为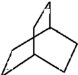 ,分子中有两种不同的H原子,以此解答(1)(2)(3)
,分子中有两种不同的H原子,以此解答(1)(2)(3)
(4)X的分子式为C8H8,有机物Z、W分别是X的同分异构体,其中Z是一种芳香烃,应为苯乙烯,W既不能使溴水褪色,也不能使KMnO4酸性溶液褪色,且W的一氯代物只有一种,应为饱和烃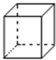 ,以此解答该题.
,以此解答该题.
 ,分子中有两种不同的H原子,以此解答(1)(2)(3)
,分子中有两种不同的H原子,以此解答(1)(2)(3)(4)X的分子式为C8H8,有机物Z、W分别是X的同分异构体,其中Z是一种芳香烃,应为苯乙烯,W既不能使溴水褪色,也不能使KMnO4酸性溶液褪色,且W的一氯代物只有一种,应为饱和烃
 ,以此解答该题.
,以此解答该题.解答:
解:(1)X含有碳碳双键,不含苯环,为不饱和烃,故答案为:D;
(2)A.X碳原子数大于4,常温常压下呈液态,故A错误;
B.烃类物质都难溶于水,易溶于有机溶剂,故B正确;
C.含有碳碳双键,能使溴的四氯化碳溶液褪色,故C正确;
D.含有碳碳双键,能使KMnO4酸性溶液褪色,故D正确.
故答案为:A;
(3)与氢气发生加成反应的产物为 ,分子中C原子可标识为
,分子中C原子可标识为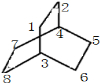 ,则二氯代物中,两个氯原子可为1、2;1、3;1、4;1、5;3、4;3、6;3、5等7种不同的位置,即二氯代物有7种,
,则二氯代物中,两个氯原子可为1、2;1、3;1、4;1、5;3、4;3、6;3、5等7种不同的位置,即二氯代物有7种,
故答案为:7;
(4)①W既不能使溴水褪色,也不能使KMnO4酸性溶液褪色,且W的一氯代物只有一种,应为 ,故答案为:
,故答案为: ;
;
②Z是一种芳香烃,应为苯乙烯,发生聚合反应的方程式为 ,
,
故答案为: .
.
(2)A.X碳原子数大于4,常温常压下呈液态,故A错误;
B.烃类物质都难溶于水,易溶于有机溶剂,故B正确;
C.含有碳碳双键,能使溴的四氯化碳溶液褪色,故C正确;
D.含有碳碳双键,能使KMnO4酸性溶液褪色,故D正确.
故答案为:A;
(3)与氢气发生加成反应的产物为
 ,分子中C原子可标识为
,分子中C原子可标识为 ,则二氯代物中,两个氯原子可为1、2;1、3;1、4;1、5;3、4;3、6;3、5等7种不同的位置,即二氯代物有7种,
,则二氯代物中,两个氯原子可为1、2;1、3;1、4;1、5;3、4;3、6;3、5等7种不同的位置,即二氯代物有7种,故答案为:7;
(4)①W既不能使溴水褪色,也不能使KMnO4酸性溶液褪色,且W的一氯代物只有一种,应为
 ,故答案为:
,故答案为: ;
;②Z是一种芳香烃,应为苯乙烯,发生聚合反应的方程式为
 ,
,故答案为:
 .
.
点评:本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,本题注意同分异构体的判断,为易错点,难度中等.

练习册系列答案
相关题目
下列各组物质相互反应时,产生的气体能燃烧的是( )
| A、碳化钙[CaC2]投入水中 |
| B、炽热的焦炭投入浓硝酸中 |
| C、少量的二氧化锰加入双氧水中 |
| D、乙醇和浓硫酸共热至170℃ |
下列有机物中,对于可能在一个平面上的最多原子数目的判断,正确的是( )
| A、丙烷最多有6个原子处于同一平面上 |
| B、环己烷最多有12个原子处于同一平面上 |
C、苯乙烯(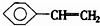 )最多有16个原子处于同一平面上 )最多有16个原子处于同一平面上 |
| D、CH3CH=CH-C≡C-CF3最多有10个原子处于同一平面上 |

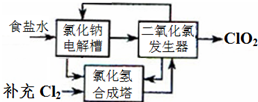 二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.