题目内容
【题目】I、将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g) +B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s 内正反应的化学反应速率为___________________;
(2)反应前A的物质的量浓度是___________________________;
Ⅱ、某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) 反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为___________。
2SO3(g) 反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为___________。
III、已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
下列能说明该反应已经达到平衡状态的是___________;
A.容器中气体总质量不变 B.c(O2)不变 C.v (O2)=1.25 v(NH3)
D.体系压强不变 E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
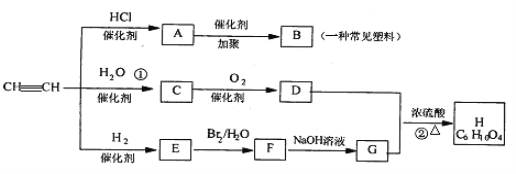
Ⅳ、在一定条件下,可实现如图所示物质之间的变化:

(1)已知孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。
则图中的F是____________(填化学式)。
(2)写出明矾[KAl(SO4)2·12H2O] 与过量NaOH溶液反应的离子方程式:
_____________________________________________。
(3)图中所得C和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式:
________________________________________________。
Ⅴ、海带提碘的流程如下:

(1)第②步为了加快溶解速率并使充分进入溶液中,可以采取的措施是:
______________________、______________________(写出两条)。
(2)写出第④步发生反应的离子方式_____________________________。
【答案】 0.04mol·L-1·s-1 1.5 mol·L-1 33.3% BDE CO2 Al3++4OH-== AlO![]() +2H2O 3CuO+2Al
+2H2O 3CuO+2Al![]() Al2O3+3Cu 充分搅拌 加热 H2O2 + 2H+ +2I— =I2 +2H2O
Al2O3+3Cu 充分搅拌 加热 H2O2 + 2H+ +2I— =I2 +2H2O
【解析】I(1)反应前C的物质的量为0.反应后C的物质的量为0.8mol,所以C的物质的量的变化量为0.8mol,

用C表示10s 内正反应的化学反应速率为: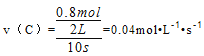
(2)所以A反应前的物质的量为1.2mol+1.8mol=3.0mo,反应前A的物质的量浓度是:![]()
Ⅱ、设平衡时转化的氧气的物质的量为x,利用三段式法计算.
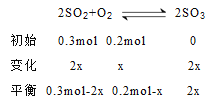
同温同体积下:![]() ,解得x=0.05mol。
,解得x=0.05mol。
平衡时反应的物质的量为2×0.05mol=0.1mol,则SO2的转化率为![]() 。
。
III、A.反应前后都是气体,容器中气体总质量始终不变,故A错误; B.c(O2)不变,说明正逆反应速率相等,达到了平衡状态,故B正确;C.v (O2)=1.25 v(NH3),没有说明是正逆反应速率,无法判断是否达到平衡,故C错误;D.该反应是体积缩小的反应,反应过程中气化的物质的量逐渐减小,压强逐渐减小,体系压强不变,说明正逆反应速率相等,达到了平衡状态,故D正确;E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO,说明正逆反应速率相等,达到了平衡状态,故E正确;故选BDE。
Ⅳ、孔雀石的主要成分是CuCO3·Cu(OH)2 (碱式碳酸铜),受热易分解的产物为氧化铜、水、二氧化碳,明矾的主要成分是KAl(SO4)2 ·12H2O,其中的铝离子能和过量NaOH溶液反应生成偏铝酸钠水溶液,所以A为:NaAlO2,碱式碳酸铜受热易分解的产物中,只有二氧化碳可以和A反应,所以F为CO2,G为氧化铜,B为氢氧化铝受热分解的产物B为氧化铝,电解熔融氧化铝生成铝和氧气,
(1)由上述分析可知F为CO2,故答案为:CO2;
(2)明矾溶液与过量NaOH溶液反应的实质是:铝离子和氢氧根之间的反应,离子方程式为:Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(3)G为氧化铜,若D为固体,则D为Al,铝和氧化铜高温下的发生铝热反应,该反应化学方程式为: 3CuO+2Al![]() Al2O3+3Cu 。
Al2O3+3Cu 。
Ⅴ、(1)加热、搅拌、适当延长浸取时间、少量溶剂o次浸取,研磨能加快溶解速度;
故答案为:加热煮沸;充分搅拌;(2)④中在酸性溶液下反应是过氧化氢氧化碘离子为碘单质,反应的离子方程式为:H2O2+2I-+2H+=I2+2H2O;

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组进行有关卤素及其化合物的制备和性质探究实验,请同学们参与他们的实验并回答下列问题。
【实验一】氯气的制备与性质
(1)用下图所示的实验装置来制备纯净、干燥的氯气,并完成它与金属铁的反应。每个虚线框表示一个单元装置,其中有错误的是_____(填字母序号)。
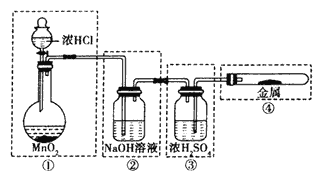
A.只有②和④ B.只有② C.只有①和③ D.②③④
【实验二】卤素化合物的性质实验探究
已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在100℃左右时升华,易溶于水并且有强烈的吸水性。在500℃条件下氯化亚铁与氧气可能发生多种反应,如:12FeCl2+3O2![]() 2Fe2O3+8FeCl3、4FeCl2+3O2
2Fe2O3+8FeCl3、4FeCl2+3O2![]() 2Fe2O3+4Cl2等。该兴趣小组选用以下部分装置(夹持装置省略,装置不可重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3+4Cl2等。该兴趣小组选用以下部分装置(夹持装置省略,装置不可重复选用)进行氯化亚铁与氧气反应产物的探究。
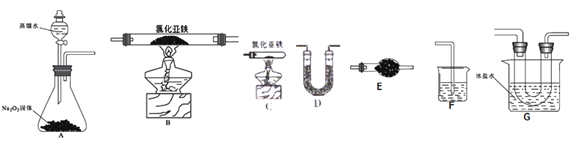
(2)实验装置的合理连接顺序为:A→____________→F。
(3)A装置中反应的化学方程式为________________。
(4)当加热装置中充分反应后,余下的固体是_________;本套实验装置的主要缺点是_____________。
(5)利用反应生成的FeCl3设计实验证明Fe(OH)3是弱碱,实验方案为____________。
【实验三】卤素化合物反应实验条件控制探究
(6)在不同实验条件下KClO3可将KI氧化为I2或KIO3。该小组设计了一系列实验来研究反应条件对反应物的影响,其中某一实验的数据记录如下(实验控制在室温下进行):
试管标号 | 1 | 2 | 3 | 4 |
0.20mol·L-1KI溶液/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0mol/L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①该组实验的目的是________________________。
②设计1号试管实验的作用是_______________________。
③若2号试管实验现象为“反应后溶液呈黄色”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__________________。