题目内容
【题目】反应4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 ![]() (X)(反应物的消耗速率或产物的生成速率)可表示为
(X)(反应物的消耗速率或产物的生成速率)可表示为
A.![]() (NH3) = 0.010 mol/(L·s)
(NH3) = 0.010 mol/(L·s)
B.![]() (O2) = 0.0010 mol/(L·s)
(O2) = 0.0010 mol/(L·s)
C.![]() (NO) = 0.0010 mol/(L·s)
(NO) = 0.0010 mol/(L·s)
D.![]() (H2O) = 0.045 mol/(L·s)
(H2O) = 0.045 mol/(L·s)
【答案】C
【解析】
试题分析:在体积10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol.
则v(H2O)=![]() =0.0015molL-1s-1,A、速率之比等于化学计量数之比,所以v(NH3)=
=0.0015molL-1s-1,A、速率之比等于化学计量数之比,所以v(NH3)=![]() ×0.0015molL-1s-1=0.0010molL-1s-1,故A错误;B、速率之比等于化学计量数之比,所以v(O2)=
×0.0015molL-1s-1=0.0010molL-1s-1,故A错误;B、速率之比等于化学计量数之比,所以v(O2)=![]() ×0.0015molL-1s-1=0.00125molL-1s-1,故B错误;C、速率之比等于化学计量数之比,所以v(NO)=
×0.0015molL-1s-1=0.00125molL-1s-1,故B错误;C、速率之比等于化学计量数之比,所以v(NO)=![]() ×0.0015molL-1s-1=0.0010molL-1s-1,故C正确;
×0.0015molL-1s-1=0.0010molL-1s-1,故C正确;
D、v(H2O)=![]() =0.0015molL-1s-1,故D错误.故选:C.
=0.0015molL-1s-1,故D错误.故选:C.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
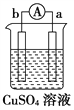
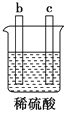
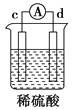
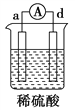
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验 装置 |
装置一 |
装置二 |
装置三 |
装置四 |
部分实验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极 流向d极 |
由此可判断这四种金属活动性顺序是( )
A. a>b>c>d B. b>c>d>a C. a>b>d>c D. d>a>b>c