题目内容
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为____________________。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为_______________。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于_________________。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为___________,中心原子杂化类型为_________。
(5)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为_______ (填序号)。
(6)Cl2和水能发生反应,生成物中有一种为三原子分子,写出该化合物的电子式_______。
【答案】 4s24p5 IBr>ICl>Cl2 HF分子之间能形成氢键 V形 sp3 ①>②>③ ![]()
【解析】(1)溴原子的质子数为35,核外电子数为35,由核外电子排布规律可知,其电子排布式为1s22s22p63s23p63d104s24p5,故其价电子排布式为:4s24p5;(2)Cl2、BrI、ICl结构相似,都是可以形成分子晶体,因相对分子质量BrI>ICl>Cl2 ,则范德华力BrI>ICl>Cl2 ,故沸点:BrI>ICl>Cl;(3)因F的电负性最大,则HF分子中存在氢键形成二聚分子;(4)I3+可看成II2+,中心I原子的价层电子对数为=(7+1×21)/2=4,中心I原子的孤电子对数为(711×2)/
2=2,则I3+的空间构型为V形,中心I原子采取sp3杂化;(5)因非金属性Cl>I,非金属性越强,则对应的最高价氧化物的酸性越强,则①的酸性最强,在②③中都是碘元素的含氧酸,非羟基氧个数越多,酸性越强,则酸性到为②>③,故答案为:①>②>③;(6)Cl2和水能发生反应,生成物中有一种为三原子分子,该分子是次氯酸,电子式为![]() 。
。

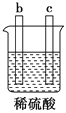
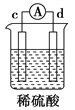
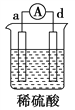
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验 装置 |
装置一 |
装置二 |
装置三 |
装置四 |
部分实验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极 流向d极 |
由此可判断这四种金属活动性顺序是( )
A. a>b>c>d B. b>c>d>a C. a>b>d>c D. d>a>b>c