题目内容
19.为探究Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验:| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中 2将一小段用砂纸打磨后的镁带,放入试管中,加入少量水,加热至水沸腾,再向试管中滴加酚酞溶液 3将一小段镁带投入稀盐酸中 4将一小片铝投入稀盐酸中. |
| 实验现象 | A剧烈反应,迅速生成大量的气体 B浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C反应不剧烈,产生无色气体 D有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)实验结论金属性强弱顺序是Na>Mg>Al.
(4)请补充该小组同学用原子结构理论解释的上述实验结论:
同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,非金属性(填“金属性”或“非金属性”)逐渐减弱.
分析 (1)Na密度小于水,钠和水剧烈反应生成NaOH和氢气,生成的NaOH导致溶液呈碱性,无色酚酞试液遇碱变红色;
Mg和沸水反应生成氢氧化镁和氢气,氢氧化镁部分溶解于水而使溶液呈碱性,无色酚酞试液遇碱变红色;
镁和稀盐酸剧烈反应生成氯化镁和氢气;
铝性质不如镁活泼,和稀盐酸反应生成氯化铝和氢气,铝和稀盐酸反应不如镁和稀盐酸反应剧烈;
(2)钠和水反应生成NaOH和氢气;
(3)金属的金属性越强,金属与水或酸反应越剧烈,生成氢气越容易;
(4)同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,非金属性逐渐减弱.
解答 解:(1)Na密度小于水,钠和水剧烈反应生成NaOH和氢气,生成的NaOH导致溶液呈碱性,无色酚酞试液遇碱变红色;
Mg和沸水反应生成氢氧化镁和氢气,氢氧化镁部分溶解于水而使溶液呈碱性,无色酚酞试液遇碱变红色;
镁和稀盐酸剧烈反应生成氯化镁和氢气;
铝性质不如镁活泼,和稀盐酸反应生成氯化铝和氢气,铝和稀盐酸反应不如镁和稀盐酸反应剧烈,
所以钠和水反应现象为B、镁和沸水反应现象为D、镁和稀盐酸反应现象为A、铝和稀盐酸反应现象为C,
故答案为:B;D;A;C;
(2)钠和水反应生成NaOH和氢气,反应方程式为2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(3)金属的金属性越强,金属与水或酸反应越剧烈,生成氢气越容易,钠和水反应很剧烈、镁能和沸水反应、Mg和Al都与稀盐酸反应但镁比铝反应剧烈,所以得到的结论是:金属性强弱顺序是Na>Mg>Al,
故答案为:金属性强弱顺序是Na>Mg>Al;
(4)同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,非金属性逐渐减弱,
故答案为:减小;减弱;金属性.
点评 本题考查性质实验方案评价,为高频考点,采用对比方法分析金属的金属性强弱,熟练掌握同一周期、同一主族元素金属性及非金属性强弱顺序及判断方法,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 稀硫酸与氢氧化钡反应:Ba2++SO42-═BaSO4↓ | |
| B. | 铁和稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化铜溶于稀硫酸:Cu(OH)2+2H+═2H2O+Cu2+ | |
| D. | 盐酸与石灰石溶液反应:CO32-+2H+═H2O+CO2↑ |

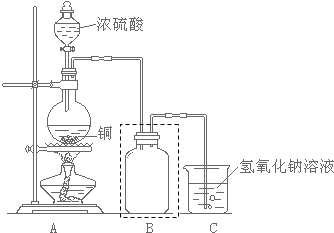
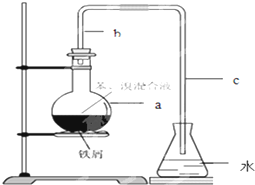 化学课外小组用如图装置制取溴苯.
化学课外小组用如图装置制取溴苯. .
.
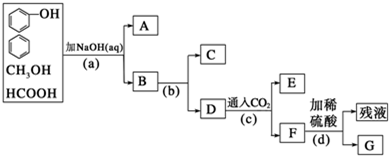
 某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质
某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质