题目内容
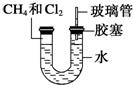
9. 某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质
某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质(1)利用Ⅰ、Ⅱ装置制取气体(K2关闭、K1打开),甲同学认为:利用Ⅱ装置可以收集H2等气体,但不能收集O2、NO2或NO气体,其理由是O2、NO2密度比空气大,NO与空气密度相差不大且与空气中的氧气反应.
(2)乙同学认为:利用Ⅱ装置作简单改进(但不改变瓶口朝向),
也可以收集O2、NO等气体,但不能收集NO2气体,其改进的方法
是将Ⅱ装置加满水.
(3)丙同学想利用上述装置比较H2SO4、H2CO3和H2SiO3的酸性强弱(不必再选用其它酸性溶液,且通过一次实验就可以达到目的).实验时,K1关闭、K2打开.锥形瓶内装Na2CO3固体,装置C(试管)中所盛的试剂是Na2SiO3溶液;实验确认H2SO4、H2CO3和H2SiO3的酸性强弱出现的现象是装置Ⅰ中产生气泡、装置C中产生白色沉淀.
(4)丁同学想证明氧化性:Ca(ClO)2>Cl2>Br2,实验时,K1关闭、K2打开,则在A中加浓盐酸;B中加Ca(ClO)2,C中加NaBr溶液溶液,观察到C中的现象是溶液由无色变为橙色或黄色或橙红色;但是此装置在完成这个实验时尚存不足,其不足是氯气易逸出污染环境.
分析 (1)Ⅱ装置中进气管短,出气管长,为向下排空气法;NO与氧气反应;
(2)用排水法可以收集O2和NO等气体,二氧化氮与水反应,且易溶于水;
(3)比较H2SO4、H2CO3和H2SiO3的酸性强弱,可在Ⅰ中用碳酸钠和稀硫酸反应生成二氧化碳,Ⅲ为硅酸钠,与二氧化碳反应可生成硅酸沉淀;
(4)比较Ca(ClO)2>Cl2>Br2氧化性强弱,在Ⅰ中Ca(ClO)2与浓盐酸反应生成氯气,氯气与Ⅲ中NaBr溶液反应生成溴,溶液颜色由无色变为橙色或橙红色,注意防止氯气污染环境.
解答 解:(1)Ⅱ装置中进气管短,出气管长,为向下排空气法,O2、NO2的密度大于空气的密度,则O2、NO2应采用向上排空气法收集;一氧化氮和氧气能发生反应生成二氧化氮,一氧化氮应采用排水法收集,所以该装置不能收集氧气和一氧化氮,
故答案为:O2、NO2密度比空气大,NO与空气密度相差不大且与空气中的氧气反应;
(2)O2 和NO不能与水发生反应,而且难溶于水,所以能采用排水法收集,
故答案为:将Ⅱ装置加满水;
(3)比较H2SO4、H2CO3和H2SiO3的酸性强弱,可在Ⅰ中用碳酸钠和稀硫酸反应生成二氧化碳,Ⅲ为硅酸钠,与二氧化碳反应可生成硅酸沉淀,
故答案为:Na2CO3;Na2SiO3溶液;装置Ⅰ中产生气泡、装置C中产生白色沉淀;
(4)比较Ca(ClO)2>Cl2>Br2氧化性强弱,在Ⅰ中Ca(ClO)2与浓盐酸反应生成氯气,氯气与Ⅲ中NaBr溶液反应生成溴,溶液颜色由无色变为橙色或橙红色,注意防止氯气污染环境,可用氢氧化钠溶液吸收氯气,
故答案为:浓盐酸;NaBr溶液;溶液由无色变为橙色或黄色或橙红色;氯气易逸出污染环境.
点评 本题考查了实验方案设计,题目难度中等,注意根据气体的性质及密度选择相应的收集方法以及实验设计的方案的设计,侧重于考查学生对实验原理的把握和对仪器的使用.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中 2将一小段用砂纸打磨后的镁带,放入试管中,加入少量水,加热至水沸腾,再向试管中滴加酚酞溶液 3将一小段镁带投入稀盐酸中 4将一小片铝投入稀盐酸中. |
| 实验现象 | A剧烈反应,迅速生成大量的气体 B浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C反应不剧烈,产生无色气体 D有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)实验结论金属性强弱顺序是Na>Mg>Al.
(4)请补充该小组同学用原子结构理论解释的上述实验结论:
同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,非金属性(填“金属性”或“非金属性”)逐渐减弱.
| A. | 6molC+xmolD(x>0.6) | |
| B. | 1molA+0.5molB+1.5molC+xmolD(x>0.1) | |
| C. | 3molA+1.5molB+x molD(x≥0) | |
| D. | 1molA+0.5molB+3molC+xmolD(x>0) |
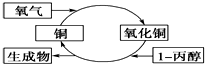
| A. | 生成物是丙酮 | |
| B. | 1-丙醇发生了还原反应 | |
| C. | 反应中有红黑颜色交替变化的现象发生 | |
| D. | 醇类都能发生图示的催化氧化反应 |
| A. | NH4Cl溶液加水稀释,恢复至室温后,pH变大 | |
| B. | 稀释0.1 mol•L-1醋酸溶液,溶液中离子的浓度均变小 | |
| C. | 在 NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 将A1C13溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体的成分相同 |
| A. | 金属Na、Mg、Al、Fe都能和盐酸反应,生成氢气 | |
| B. | Fe2O3、Al2O3、MgO都是致密的氧化膜,能保护内层金属不被腐蚀 | |
| C. | Na2O2和Na2O都能和水反应 | |
| D. | Fe(OH)3、Al(OH)3都能与NaOH溶液反应 |