题目内容
8.一定质量的钠、镁、铝分别与足量的稀盐酸反应(1)若相同条件下放出氢气的体积比为1:2:3时,钠、镁、铝的物质的量之比为1:1:1
(2)若相同条件下放出氢气的体积比为1:1:1时,钠、镁、铝的物质的量之比为6:3:2
(3)若相同条件下放出氢气的体积相同,则所需金属质量最小的是铝.
分析 (1)(2)(3)发生反应:2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,根据方程式计算解答;
解答 解:(1)发生反应:2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,因为生成氢气的体积比为1:2:3时,相同条件下体积之比等于物质的量之比,所以可以设氢气的体积分别为:1mol、2mol、3mol,根据方程式,消耗钠、镁、铝的物质的量分别为2mol、2mol、2mol,所以之比为:1:1:1,故答案为:1:1:1;
(2)若相同条件下放出氢气的体积比为1:1:1时,相同条件下体积之比等于物质的量之比,所以可以设氢气的体积分别为:6mol、6mol、6mol,钠、镁、铝的物质的量之比为12mol、6mol、4mol,所以之比为:6:3:2,故答案为:6:3:2;
(3)若相同条件下放出氢气的体积相同,相同条件下体积之比等于物质的量之比,所以可以设氢气的体积分别为:6mol、6mol、6mol,钠、镁、铝的质量分别为12mol×23g/mol=276g、6mol×24g/mol=144g、4mol×27g/mol=108g,所以所需金属质量最小的是铝,故答案为:铝.
点评 本题考查根据方程式进行的计算,比较基础,(3)利用电子转移守恒进行更为简单,生成氢气相等,转移电子相等,而铝的摩尔电子质量最小.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
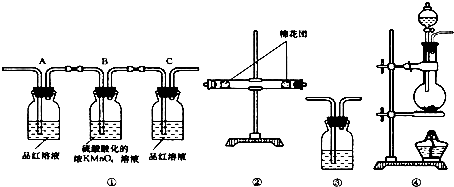
7.下列实验操作中错误的是( )
| A. | 试用分液漏斗分液时,应将漏斗颈上的玻璃塞打开 | |
| B. | 蒸馏实验不一定使用温度计 | |
| C. | 用CCl4萃取碘水中的碘 | |
| D. | 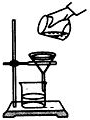 过滤(如图)时,可将悬浊液从烧杯直接倒入漏斗中 过滤(如图)时,可将悬浊液从烧杯直接倒入漏斗中 |
19.为探究Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验:
(1)请在下表中填写与实验步骤对应的实验现象编号:
(2)请写出钠与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(3)实验结论金属性强弱顺序是Na>Mg>Al.
(4)请补充该小组同学用原子结构理论解释的上述实验结论:
同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,非金属性(填“金属性”或“非金属性”)逐渐减弱.
| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中 2将一小段用砂纸打磨后的镁带,放入试管中,加入少量水,加热至水沸腾,再向试管中滴加酚酞溶液 3将一小段镁带投入稀盐酸中 4将一小片铝投入稀盐酸中. |
| 实验现象 | A剧烈反应,迅速生成大量的气体 B浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C反应不剧烈,产生无色气体 D有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)实验结论金属性强弱顺序是Na>Mg>Al.
(4)请补充该小组同学用原子结构理论解释的上述实验结论:
同周期元素从左至右原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,非金属性(填“金属性”或“非金属性”)逐渐减弱.
3.下列分子中,所有原子的最外层均为8电子结构的是( )
| A. | BeCl2和PCl5 | B. | HClO和SO2 | C. | P4和COS(羰基硫) | D. | SiO2和NaCl |
13.与氖的核外电子排布相同的离子跟与氩核外电子排布相同的离子所形成的化合物是( )
| A. | MgBr2 | B. | Na2S | C. | KI | D. | KCl |
20.在一个1L的容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)?3C(g)+D(s).平衡时,C的浓度为1.2mol/L.维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,下列组合能达到的是( )
| A. | 6molC+xmolD(x>0.6) | |
| B. | 1molA+0.5molB+1.5molC+xmolD(x>0.1) | |
| C. | 3molA+1.5molB+x molD(x≥0) | |
| D. | 1molA+0.5molB+3molC+xmolD(x>0) |
17.某化学反应过程如图所示,由图得出的判断,正确的是( )
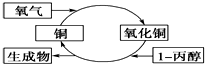

| A. | 生成物是丙酮 | |
| B. | 1-丙醇发生了还原反应 | |
| C. | 反应中有红黑颜色交替变化的现象发生 | |
| D. | 醇类都能发生图示的催化氧化反应 |