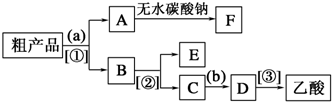
题目内容
12.下列有关叙述中错误的是( )| A. | 元素的性质随着核电荷数的递增而呈周期性变化 | |
| B. | 原子的原子核都是由质子和中子构成的 | |
| C. | 两个原子如果核外电子排布相同,一定是同一种元素 | |
| D. | 原子的次外层电子数不一定是8个 |
分析 A.原子核外最外层电子决定元素的性质;
B.1H不含中子;
C.原子核外电子数等于质子数;
D.如为第二周期元素,则次外层电子数为2.
解答 解:A.元素的性质随原子核外电子排布的周期性变化而变化,则元素的性质随着核电荷数的递增而呈周期性变化,故A正确;
B.1H不含中子,则原子核不一定都是由质子和中子构成的,故B错误;
C.原子核外电子数等于质子数,质子数相同的原子,一定属于相同元素,故C正确;
D.如为第二周期元素,则次外层电子数为2,故D正确.
故选B.
点评 本题考查元素周期表和元素周期律,为高频考点,把握主族元素及同周期元素性质的变化规律为解答的关键,注意元素的位置及特性,理解元素周期律的实质,把握原子的构成特点,题目难度不大.

练习册系列答案
相关题目
18.某氯化镁溶液的密度为d g•cm-3,其中镁离子的质量分数为ω,a mL该溶液的Cl-的物质的量为( )
| A. | $\frac{adω}{24}$mol | B. | $\frac{dω}{24a}$mol | C. | $\frac{adω}{22400}$mol | D. | $\frac{adω}{12}$mol |
3.下列除去杂质所用的试剂和方法错误的是( )
| A. | 除去Na2CO3 固体中混有的少量的NaHCO3:置于坩埚中加热 | |
| B. | 除去FeCl2溶液中的FeCl3:加入铁粉 | |
| C. | 除去氢氧化铁胶体中所含的盐酸:过滤 | |
| D. | 除去CO2中混有的少量的HCl:通过饱和的NaHCO3溶液中洗气 |
20.下列变化过程中需要吸收能量的是( )
| A. | 2H2+O2═2H2O | B. | H2→2H | C. | CaO+H2O═Ca(OH)2 | D. | H++OH-=H2O |
7.化合物Y2X在水中能电离出具有相同电子层结构的阴阳离子,该化合物可能为( )
| A. | H2O | B. | Na2O | C. | K2S | D. | Na2S |
17.可以证明乙醇分子中有一个氢原子与另外氢原子不同的方法是( )
| A. | 1 mol乙醇燃烧生成3 mol水 | |
| B. | 乙醇可以制饮料 | |
| C. | 1 mol乙醇跟足量的Na作用得0.5 mol H2 | |
| D. | 乙醇代替汽油做燃料,污染小,更环保 |
1.下列反应的离子方程式书写正确的是( )
| A. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化钡溶液与稀 H2SO4:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| C. | 向氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ |
 .
.