题目内容
7.化合物Y2X在水中能电离出具有相同电子层结构的阴阳离子,该化合物可能为( )| A. | H2O | B. | Na2O | C. | K2S | D. | Na2S |
分析 两元素形成的化合物在水溶液中能电离出电子层结构相同的阴阳离子,则阴、阳离子的核外电子数相等结合化合物Y2X组成,逐项进行判断.
解答 解:A、H2O在水中能电离出氢离子核外电子数为0,氢氧根离子的核外电子数为为10,核外电子数不相等,故A错误;
B、Na2O中钠离子与氧离子的核外电子数相等,都为10,但在溶液中不能电离出氧离子,故B错误;
C、K2S中钾离子与硫离子的核外电子数相等,都为18,故C正确;
D、Na2S中钠离子与硫离子的核外电子数不相等,故D错误.
故选C.
点评 本题考查原子及离子结构、化合物性质等,难度不大,注意审题要仔细、细心.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
13.两种有机物以一定比例混合,一定条件下在a L O2(足量)中燃烧,充分反应后恢复到原状态,再通过足量Na2O2层,得到气体仍是a L,下列混合有机物中符合此条件的是( )
| A. | CH4、C2H4 | B. | CH3OH、CH3COOH | C. | C2H6、HCHO | D. | HCHO、CH3COOCH3 |
15.有关18O的叙述正确的是( )
| A. | 与O3中普通氧原子的化学性质不同 | B. | 是O3的同素异形体 | ||
| C. | 与23Na含的中子数相同 | D. | 与16O互为同位素 |
2.下列分子结构中,所有原子的最外层满足8电子稳定结构的是( )
| A. | SO2 | B. | PCl5 | C. | NH3 | D. | CS2 |
12.下列有关叙述中错误的是( )
| A. | 元素的性质随着核电荷数的递增而呈周期性变化 | |
| B. | 原子的原子核都是由质子和中子构成的 | |
| C. | 两个原子如果核外电子排布相同,一定是同一种元素 | |
| D. | 原子的次外层电子数不一定是8个 |
19.若1mol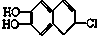 分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )
分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )
 分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )
分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )| A. | 2mol、4mol、2mol | B. | 2mol、3mol、3mol | C. | 3mol、2mol、2mol | D. | 3mol、4mol、3mol |
16.以下物质间的每步转化都可以通过一步反应能实现的是( )
| A. | Al→Al2O3→Al(OH)3→Na[Al(OH)4] | B. | Fe→FeO→Fe(OH)2→Fe(OH)3 | ||
| C. | Si→SiO2→H2SiO3→Na2SiO3 | D. | Na→Na2O2→Na2CO3→NaOH |
17.根据下列短周期元素性质的数据判断,下列说法正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径∕10-10m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.24 |
| 最高价或最低价 | -2 | +2 | +1 | +5 -3 | +7 -1 | +1 | +5 -3 | +3 |
| A. | 元素④⑤形成的化合物是离子化合物 | |
| B. | 元素⑦位于第二周期第V族 | |
| C. | 元素①⑧形成的化合物具有两性 | |
| D. | 元素③的最高价氧化物对应水化物的碱性最强 |