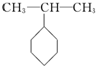
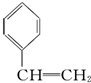
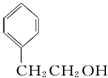
题目内容
17.可以证明乙醇分子中有一个氢原子与另外氢原子不同的方法是( )| A. | 1 mol乙醇燃烧生成3 mol水 | |
| B. | 乙醇可以制饮料 | |
| C. | 1 mol乙醇跟足量的Na作用得0.5 mol H2 | |
| D. | 乙醇代替汽油做燃料,污染小,更环保 |
分析 乙醇分子式为C2H6O,结构简式为C2H5OH,乙醇含有-OH,可发生取代、氧化和消去反应,可与钠反应,乙醇共含有6个H原子,但只有羟基与钠反应,可根据与钠反应生成氢气的量判断,以此解答.
解答 解:A.1mol乙醇燃烧生成3mol水即乙醇燃烧所有的氢元素均生成水,不能证明乙醇分子中有一个氢原子与另外氢原子不同,故A错误;
B.乙醇制饮料的过程不发生化学反应,不能证明乙醇分子中有一个氢原子与另外氢原子不同,故B错误;
C.1mol乙醇跟足量的Na作用得0.5molH2,很明显乙醇中的6个氢只有一个能变为氢气,这个氢与其他氢不同,故C正确;
D.1mol乙醇燃烧生成2molCO2和水,代替汽油做燃料,污染小,更环保,但不能证明乙醇分子中有一个氢原子与另外氢原子不同,故D错误;
故选C.
点评 本题考查有机物的结构和性质,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质和结构特点,学习中注意乙醇的性质,难度不大.

练习册系列答案
相关题目
8.一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1).
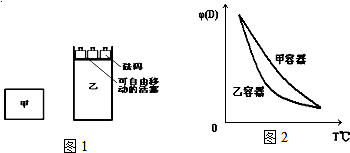
关于两容器中反应的说法正确的是( )

关于两容器中反应的说法正确的是( )
| A. | 甲容器中的反应先达到化学平衡状态 | |
| B. | 两容器中反应均达平衡后,平衡体系中各组分的体积百分组成相同,浓度也相同 | |
| C. | 两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 | |
| D. | 在甲容器中再充入2 mol A和2 mol B,平衡后甲中c(C)是乙中c(C)的2倍 |
5.在某一温度下,某碳氢化合物的蒸气对氢气的相对密度为53.则该化合物的分子式为( )
| A. | C8H10 | B. | CH4 | C. | CH3CH2OH | D. | C5H10 |
12.下列有关叙述中错误的是( )
| A. | 元素的性质随着核电荷数的递增而呈周期性变化 | |
| B. | 原子的原子核都是由质子和中子构成的 | |
| C. | 两个原子如果核外电子排布相同,一定是同一种元素 | |
| D. | 原子的次外层电子数不一定是8个 |
2.甲烷分子中4个氢原子被苯基取代,可得如图所示分子,对该分子的描述正确的是( )
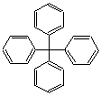

| A. | 此物质属于芳香烃 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 此分子的一氯取代产物有12种 | D. | 此物质分子式为C25H20 |
9.将甲烷与氯气按物质的量之比1:3混合,光照条件下发生化学反应后,得到的有机产物是( )
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4.
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4.
| A. | 只有① | B. | 只有③ | C. | ①②③的混合物 | D. | ①②③④的混合物 |