题目内容
18.某氯化镁溶液的密度为d g•cm-3,其中镁离子的质量分数为ω,a mL该溶液的Cl-的物质的量为( )| A. | $\frac{adω}{24}$mol | B. | $\frac{dω}{24a}$mol | C. | $\frac{adω}{22400}$mol | D. | $\frac{adω}{12}$mol |
分析 根据m=ρV计算溶液的质量,结合镁离子质量分数计算镁离子质量,根据n=$\frac{m}{M}$计算镁离子物质的量,溶液中氯离子浓度为镁离子浓度2倍.
解答 解:溶液中镁离子的质量为a mL×d g•mL-3×ω=adω g,
故镁离子物质的量为$\frac{adω}{24}$mol,
则氯离子物质的量为$\frac{adω}{24}$mol×2=$\frac{adω}{12}$mol,
故选D.
点评 本题考查质量分数计算、物质的量计算,注意对公式的理解与灵活运用,难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目
8.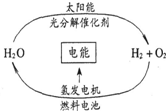 目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如右图).关于此循环体系,下列说法中错误的是( )
目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如右图).关于此循环体系,下列说法中错误的是( )
 目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如右图).关于此循环体系,下列说法中错误的是( )
目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如右图).关于此循环体系,下列说法中错误的是( )| A. | 燃料电池能够使化学反应产生的能量转化为电能 | |
| B. | 在此循环中发生了反应:2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+O2↑ | |
| C. | 该氢能源的循环体系能够实现太阳能转化为电能 | |
| D. | 目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 |
9.下列说法正确的是( )
| A. | 共价键都具有方向性 | |
| B. | 键能越大表示该分子越容易受热分解 | |
| C. | 乙醇分子与水分子之间只存在范德华力 | |
| D. | 氯的各种含氧酸的酸性由强到弱排列为HClO4>HClO3>HClO2>HClO |
6.能正确表示下列反应的离子方程式是( )
| A. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 氢氧化镁与盐酸的反应:OH-+H +═H2O | |
| C. | Cl2与NaOH 溶液反应:Cl2+2OH-═Cl-+ClO- | |
| D. | 碳酸钙溶于稀盐酸中CaCO3+2H═Ca2++H2O+CO2↑ |
13.两种有机物以一定比例混合,一定条件下在a L O2(足量)中燃烧,充分反应后恢复到原状态,再通过足量Na2O2层,得到气体仍是a L,下列混合有机物中符合此条件的是( )
| A. | CH4、C2H4 | B. | CH3OH、CH3COOH | C. | C2H6、HCHO | D. | HCHO、CH3COOCH3 |
10.电子构型为[Ar]3d104s2的元素在周期表中属于( )
| A. | 稀有气体p区 | B. | 过渡元素d区 | C. | 副族元素ds区 | D. | 主族元素s区 |
11.2007年3月21日,我国公布了111号元素Rg的中文名称.该元素名称及所在周期是( )
| A. | 钅仑 第七周期 | B. | 镭 第七周期 | C. | 铼 第六周期 | D. | 氡 第六周期 |
12.下列有关叙述中错误的是( )
| A. | 元素的性质随着核电荷数的递增而呈周期性变化 | |
| B. | 原子的原子核都是由质子和中子构成的 | |
| C. | 两个原子如果核外电子排布相同,一定是同一种元素 | |
| D. | 原子的次外层电子数不一定是8个 |