题目内容
4.雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一.消除氮氧化物和硫氧化物有多种方法.可用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)═N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
分析 根据v=$\frac{△c}{△t}$计算v(CO2),NO的转化率=$\frac{NO浓度变化量}{NO起始浓度}$×100%.
解答 解:由表中数据可知,0~10min内△c(CO2)=0.21mol/L,则v(CO2)=$\frac{0.21mol/L}{10min}$=0.021mol/(L.min);
30min时,△c(NO)=1mol/L-0.4mol/L=0.6mol/L,故NO的转化率为$\frac{0.6mol/L}{1mol/L}$×100%=60%,
故答案为:0.021mol/(L.min);60%.
点评 本题考查化学平衡计算、反应速率计算,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
15.氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数.反应的化学方程式:2NH3(g)+CO2(g) $?_{分解}^{制备}$NH2COONH4(s).请按要求回答下列问题:
(1)请在图1方框内画出用浓氨水与生石灰制取氨气的装置简图.
(2)制备氨基甲酸铵的装置如图2所示.生成的氨基甲酸铵小晶体悬浮在四氯化碳中.
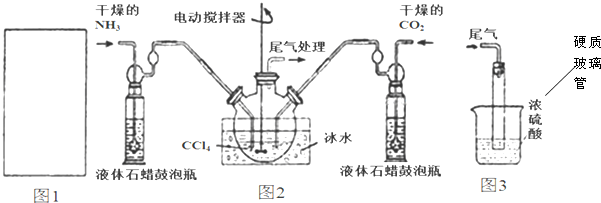
①从反应后的混合物中分离出产品的实验方法是过滤(填操作名称).
②图3中浓硫酸的作用是吸收未反应的氨气,防止空气中的水蒸气进入反应器使氨基甲酸铵水解.
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡.实验测得不同温度下的平衡数据列于下表:
①下列选项可以判断该分解反应达到平衡的是AC.
A.密闭容器内混合气体的压强不变
B.密闭容器内物质总质量不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②该分解反应的焓变△H>0(填“>”、“=”或“<”),25.0℃时分解平衡常数的值=1.6384×10-8.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”,“减少”或“不变”).
(1)请在图1方框内画出用浓氨水与生石灰制取氨气的装置简图.
(2)制备氨基甲酸铵的装置如图2所示.生成的氨基甲酸铵小晶体悬浮在四氯化碳中.

①从反应后的混合物中分离出产品的实验方法是过滤(填操作名称).
②图3中浓硫酸的作用是吸收未反应的氨气,防止空气中的水蒸气进入反应器使氨基甲酸铵水解.
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡.实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.密闭容器内混合气体的压强不变
B.密闭容器内物质总质量不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②该分解反应的焓变△H>0(填“>”、“=”或“<”),25.0℃时分解平衡常数的值=1.6384×10-8.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”,“减少”或“不变”).
12. 乙酰水杨酸俗称阿司匹林(
乙酰水杨酸俗称阿司匹林( ),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$→_{加热}^{85℃-90℃}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品主要试剂和产品的物理常数如表:
回答下列问题:
(1)合成阿司匹林时,最适合的加热方法是水浴加热.
(2)合成阿司匹林时,必须使用干燥的仪器,其原因是防止醋酸酐和水反应.
(3)减压过滤所得粗产品要用少量冰水洗涤,其目的是除去醋酸酐、醋酸、硫酸,并降低乙酰水杨酸的损耗.
(4)用重结晶方法提纯粗产品的流程如下,加热回流装置如图.
粗产品 $→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{加压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酸水杨酸
①沸石的作用是防暴沸;
②冷凝水的流进方向是a(填“a”或“b”);
③使用温度计的目的是便于调控加热温度,防止乙酰水杨酸分解.
(5)在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品质量为2.2 g,则所得乙酰水杨酸的产率为84.3%(精确到0.1).
 乙酰水杨酸俗称阿司匹林(
乙酰水杨酸俗称阿司匹林( ),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$→_{加热}^{85℃-90℃}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品主要试剂和产品的物理常数如表:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 乙酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)合成阿司匹林时,最适合的加热方法是水浴加热.
(2)合成阿司匹林时,必须使用干燥的仪器,其原因是防止醋酸酐和水反应.
(3)减压过滤所得粗产品要用少量冰水洗涤,其目的是除去醋酸酐、醋酸、硫酸,并降低乙酰水杨酸的损耗.
(4)用重结晶方法提纯粗产品的流程如下,加热回流装置如图.
粗产品 $→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{加压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酸水杨酸
①沸石的作用是防暴沸;
②冷凝水的流进方向是a(填“a”或“b”);
③使用温度计的目的是便于调控加热温度,防止乙酰水杨酸分解.
(5)在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品质量为2.2 g,则所得乙酰水杨酸的产率为84.3%(精确到0.1).
19.(1)亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应获得:NO(g)+Cl2(g)═2ClNO(g).
①氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
2NO(g)+Cl2(g)?2ClNO(g)△H3 K3
则△H3=2△H1-△H2(用△H1和△H2表示),K3=$\frac{K_1^2}{K_2}$(用K1和K2表示).
②NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O.室温下,用一定量的NaOH
溶液吸收NO、NO2混合气体,得到0.1mol/L的NaNO2溶液.已知HNO2的电离常数Ka=7.1×10-4,
那么室温下NO2-的水解常数Kh=1.4×10-11,0.1mol/L NaNO2溶液中从c(Na+ )、c(OH- )、c(NO2- )、c(HNO2)的大小顺序为c(Na+ )>c(NO2-)>c(OH-)>c(HNO2).
(2)在3.0L密闭容器中,通入0.10mol CH4和0.20mol NO2,在一定温度下进行反应,CH4(g)+2NO2(g)?CO2(g)+N2(g)+2H2O(g)△H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
①由表中数据计算0~4min内v(NO2)=0.01mol/(L•min),该温度下的平衡常数K=0.675(不必带单位).
②在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):
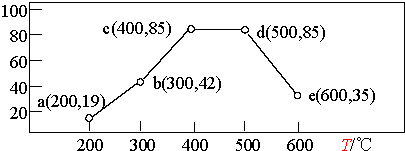
则下列叙述正确的是AD.
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v (逆)>e点的 v (逆)
C.平衡常数:c点=d点
D.提高b点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
①氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
2NO(g)+Cl2(g)?2ClNO(g)△H3 K3
则△H3=2△H1-△H2(用△H1和△H2表示),K3=$\frac{K_1^2}{K_2}$(用K1和K2表示).
②NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O.室温下,用一定量的NaOH
溶液吸收NO、NO2混合气体,得到0.1mol/L的NaNO2溶液.已知HNO2的电离常数Ka=7.1×10-4,
那么室温下NO2-的水解常数Kh=1.4×10-11,0.1mol/L NaNO2溶液中从c(Na+ )、c(OH- )、c(NO2- )、c(HNO2)的大小顺序为c(Na+ )>c(NO2-)>c(OH-)>c(HNO2).
(2)在3.0L密闭容器中,通入0.10mol CH4和0.20mol NO2,在一定温度下进行反应,CH4(g)+2NO2(g)?CO2(g)+N2(g)+2H2O(g)△H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
②在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):

则下列叙述正确的是AD.
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v (逆)>e点的 v (逆)
C.平衡常数:c点=d点
D.提高b点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
9.合成氨是人类科学技术发展史上的一项重大突破,其反应原理为:N2(g)+3H2(g)?2NH3(g)△H<0
回答下列问题:
(1)450℃时,往2L密闭容器中充人1molN2,和2.6molH2,反应过程中NH3的物质的量浓度随时间的变化情况如表所示:
 ①反应开始的5min内,生成NH3的平均反应速率为0.016mol/(L.min);平衡时H2的转化率为23.1%;该反应的平衡常数为0.1.
①反应开始的5min内,生成NH3的平均反应速率为0.016mol/(L.min);平衡时H2的转化率为23.1%;该反应的平衡常数为0.1.
②下列叙述中,能说明该合成氨反应已达到平衡的是BD(填字母代号)?
A.容器内的气体密度保持不变
B.容器内的气体压强保持不变
C.容器内N2、H2、NH3物质的量浓度之比为1:3:2
D.单位时间内消耗a molN2,同时生成3amolH2
③若再向平衡体系中充入l mol N2、2.5molH2、0.5mol NH3,平衡将正向移动(填“正向移动”、“逆向移动”或“不移动”).
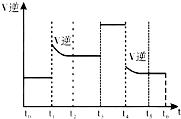
(2)由图表示反应速率与反应过程的关系,当反应达到平衡后不断改变条件(不改变N2、H2、NH3的量,每次只改变一种条件),其中t1时刻改变的条件是升高温度,表示平衡混合物中NH3的含量最高的一段时间是t0~t1段
(3)一种合成氨的新方法为:在常压下,把氢气和用氦气稀释的氮气分别通入570℃的电解池,让氢离子通过的多孔陶瓷固体作电解质,氢气和氮气在电极上合成氨,氢气转化率达到78%,该电解池阴极的电极反应式为N2+6H++6e-═2NH3.
(4)25℃时,pH=a的氨水与pH=b)的盐酸等体积混合,恰好完全反应,则该温度下原氨水电离的百分数可表示为A.
A.10(a+b-12)% B.10(a+b-14)% C.10(12-a-b)% D.10(14-a-b)%
回答下列问题:
(1)450℃时,往2L密闭容器中充人1molN2,和2.6molH2,反应过程中NH3的物质的量浓度随时间的变化情况如表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol•L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 ①反应开始的5min内,生成NH3的平均反应速率为0.016mol/(L.min);平衡时H2的转化率为23.1%;该反应的平衡常数为0.1.
①反应开始的5min内,生成NH3的平均反应速率为0.016mol/(L.min);平衡时H2的转化率为23.1%;该反应的平衡常数为0.1.②下列叙述中,能说明该合成氨反应已达到平衡的是BD(填字母代号)?
A.容器内的气体密度保持不变
B.容器内的气体压强保持不变
C.容器内N2、H2、NH3物质的量浓度之比为1:3:2
D.单位时间内消耗a molN2,同时生成3amolH2
③若再向平衡体系中充入l mol N2、2.5molH2、0.5mol NH3,平衡将正向移动(填“正向移动”、“逆向移动”或“不移动”).
(2)由图表示反应速率与反应过程的关系,当反应达到平衡后不断改变条件(不改变N2、H2、NH3的量,每次只改变一种条件),其中t1时刻改变的条件是升高温度,表示平衡混合物中NH3的含量最高的一段时间是t0~t1段
(3)一种合成氨的新方法为:在常压下,把氢气和用氦气稀释的氮气分别通入570℃的电解池,让氢离子通过的多孔陶瓷固体作电解质,氢气和氮气在电极上合成氨,氢气转化率达到78%,该电解池阴极的电极反应式为N2+6H++6e-═2NH3.
(4)25℃时,pH=a的氨水与pH=b)的盐酸等体积混合,恰好完全反应,则该温度下原氨水电离的百分数可表示为A.
A.10(a+b-12)% B.10(a+b-14)% C.10(12-a-b)% D.10(14-a-b)%
16.下列有关叙述正确的是( )
| A. |  如图所示,测定中和反应的反应热时,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯 如图所示,测定中和反应的反应热时,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯 | |
| B. | 若用50 mL 0.55 mol•L-1的氢氧化钠溶液,分别与50 mL 0.50 mol•L-1的盐酸和50 mLA0.50 mol•L-1的硝酸充分反应,两反应测定的反应热不相等 | |
| C. | 实验时需要记录初始温度T1 和最高温度T2 | |
| D. | 做一次实验根据公式即可得出中和反应的反应热 |
13.某元素原子的电子排布式是1s22s22p63s23p4,则它在周期表中的位置是( )
| A. | 第2周期第ⅣA族 | B. | 第3周期第ⅣA族 | C. | 第4周期第ⅡA族 | D. | 第3周期第ⅥA族 |
14.25℃时,下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 滴加酚酞试液显红色的溶液中:K+、Na+、NO3-、Cl- | |
| B. | c(H+)=1×10-13 mol•L-1的溶液中:Mg2+、Na+、SO42-、NO3- | |
| C. | pH=1的溶液中:Na+、K+、MnO4-、SO2 | |
| D. | 0.1 mol•L-1FeCl3溶液中:Ba2+、Na+、SCN-、Br- |