题目内容
17.HA、HB、HC三种一元弱酸溶液的浓度都是0.1mol/L在室温时,HA溶液中A的浓度是1.32×10-3mol/L,HB的电离度是1.15%,HC溶液的pH值等于3,三种酸的酸性由强到弱的顺序是HA>HB>HC.分析 等浓度的酸电离出来的氢离子浓度越大,酸的酸性越强,据此分析.
解答 解:HA、HB、HC三种一元弱酸溶液的浓度都是0.1mol/L,在室温时,HA溶液中A-的浓度是1.32×10-3mol/L,则H+的浓度为1.32×10-3mol/L,HB的电离度是1.15%,则HB中氢离子浓度为0.1mol/L×1.15%=0.00115mol/L,HC溶液的pH值等于3,则其氢离子浓度为0.001mol/L,
所以三种酸的酸性由强到弱的顺序是HA>HB>HC,
故答案为:HA>HB>HC.
点评 本题考查了酸性强弱的比较,明确溶液中氢离子浓度与酸性强弱的关系是解本题关键,题目难度不大,注意把握电离度的含义.

练习册系列答案
相关题目
7.对2P2O5的正确描述为( )
| A. | 表示五氧化二磷分子是由磷元素与氧元素组成的 | |
| B. | 表示4个磷原子和10个氧原子 | |
| C. | 表示2个五氧化二磷分子,有4个磷原子和10个氧原子 | |
| D. | 表示2个五氧化二磷分子,每个五氧化二磷分子中含有2个磷原子和5个氧原子 |
5.下列说法正确的是( )
| A. | 煤的气化、液化是物理变化,煤的干馏是化学变化 | |
| B. | C60、液氯是单质,HD、干冰是化合物,NO2是酸性氧化物 | |
| C. | 烟、雾属于胶体,能产生丁达尔效应 | |
| D. | 可用热的饱和碳酸钠溶液除去金属表面的石蜡 |
12.下列说法正确的是( )
| A. | SO2属于酸性氧化物,CaO属于碱性氧化物 | |
| B. | 盐酸,硝酸都属于无氧酸 | |
| C. | 氢氧化钠,氢氧化铁都是可溶性碱 | |
| D. | CO,CO2都是酸性氧化物 |
9.下列各组中的两稀溶液间的反应,可以用同一个离子方程式来表示的是( )
| A. | HCl与Na2CO3;HNO3与KHCO3 | B. | BaCl2与Na2SO4;Ba(OH)2与CuSO4 | ||
| C. | HCl与KOH;H2SO4与Ba(OH)2 | D. | H2SO4与NaHCO3;NaHSO4与KHCO3 |
19.(1)亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应获得:NO(g)+Cl2(g)═2ClNO(g).
①氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
2NO(g)+Cl2(g)?2ClNO(g)△H3 K3
则△H3=2△H1-△H2(用△H1和△H2表示),K3=$\frac{K_1^2}{K_2}$(用K1和K2表示).
②NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O.室温下,用一定量的NaOH
溶液吸收NO、NO2混合气体,得到0.1mol/L的NaNO2溶液.已知HNO2的电离常数Ka=7.1×10-4,
那么室温下NO2-的水解常数Kh=1.4×10-11,0.1mol/L NaNO2溶液中从c(Na+ )、c(OH- )、c(NO2- )、c(HNO2)的大小顺序为c(Na+ )>c(NO2-)>c(OH-)>c(HNO2).
(2)在3.0L密闭容器中,通入0.10mol CH4和0.20mol NO2,在一定温度下进行反应,CH4(g)+2NO2(g)?CO2(g)+N2(g)+2H2O(g)△H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
①由表中数据计算0~4min内v(NO2)=0.01mol/(L•min),该温度下的平衡常数K=0.675(不必带单位).
②在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):
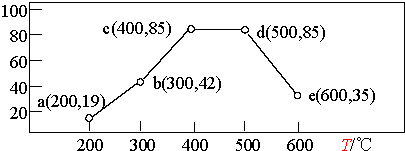
则下列叙述正确的是AD.
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v (逆)>e点的 v (逆)
C.平衡常数:c点=d点
D.提高b点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
①氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
2NO(g)+Cl2(g)?2ClNO(g)△H3 K3
则△H3=2△H1-△H2(用△H1和△H2表示),K3=$\frac{K_1^2}{K_2}$(用K1和K2表示).
②NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O.室温下,用一定量的NaOH
溶液吸收NO、NO2混合气体,得到0.1mol/L的NaNO2溶液.已知HNO2的电离常数Ka=7.1×10-4,
那么室温下NO2-的水解常数Kh=1.4×10-11,0.1mol/L NaNO2溶液中从c(Na+ )、c(OH- )、c(NO2- )、c(HNO2)的大小顺序为c(Na+ )>c(NO2-)>c(OH-)>c(HNO2).
(2)在3.0L密闭容器中,通入0.10mol CH4和0.20mol NO2,在一定温度下进行反应,CH4(g)+2NO2(g)?CO2(g)+N2(g)+2H2O(g)△H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
②在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):

则下列叙述正确的是AD.
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v (逆)>e点的 v (逆)
C.平衡常数:c点=d点
D.提高b点时NO2的转化率和反应速率,可适当升温或增大c(CH4)