题目内容
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1 mol O2与Na完全反应,转移电子数一定为4NA | |
| B. | 常温常压下,1.7克NH3中含有共价键的数目为NA | |
| C. | 142g Na2SO4和Na2HPO4混合物中含有的阴、阳离子总数是3 NA | |
| D. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA |
分析 A、根据反应后氧元素的价态可能为-1价或-2价;
B、求出氨气的物质的量,然后根据1mol氨气含3mol共价键来计算;
C、Na2SO4和Na2HPO4的摩尔质量均为142g/mol,且 Na2SO4和Na2HPO4中均由2个阳离子和1个阴离子构成;
D、标况下,三氧化硫为固体.
解答 解:A、氧气与钠反应后可能生成氧化钠或过氧化钠,即反应后氧元素的价态可能为-2价也可能为-1价,故1mol氧气可能转移4mol电子也可能转移2mol电子,故A错误;
B、1.7g氨气的物质的量为0.1mol,而1mol氨气含3mol共价键,故0.1mol氨气含0.3mol共价键,故B错误;
C、Na2SO4和Na2HPO4的摩尔质量均为142g/mol,故142g混合物的物质的量为1mol,而且Na2SO4和Na2HPO4中均由2个阳离子和1个阴离子构成,故1mol混合物中阴阳离子的物质的量为3mol,故C正确;
D、标况下,三氧化硫为固体,故不能根据气体摩尔体积来计算三氧化硫的物质的量,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)?NH3(g)+HI(g);
②2HI(g)?H2(g)+I2(g)
达到平衡时,c(H2)=0.25mol/L,c(HI)=5mol/L,
则此温度下反应①的平衡常数(单位:mol2•L-2)为( )
①NH4I(s)?NH3(g)+HI(g);
②2HI(g)?H2(g)+I2(g)
达到平衡时,c(H2)=0.25mol/L,c(HI)=5mol/L,
则此温度下反应①的平衡常数(单位:mol2•L-2)为( )
| A. | 25 | B. | 0.025 | C. | 30.25 | D. | 27.5 |
2.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价] | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | L2+与R2-的核外电子数相等 | D. | M与T形成的化合物具有两性 |
6.根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
| A. | K层电子数为偶数的所有元素所在族的序数与该元素原子的K层电子数相等 | |
| B. | L层电子数为奇数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| C. | L层电子数为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| D. | M层电子数为偶数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
16.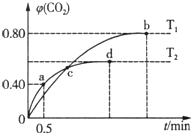 利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )
 利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )| A. | T2时,0~0.5 min内的反应速率v(CO)=1.6mol/(L•min) | |
| B. | 两种温度下,c点时体系中混合气体的压强相等 | |
| C. | d点时,增大体系压强,CO的转化率不变 | |
| D. | b点和d点时化学平衡常数的大小关系:Kb>Kd |
3.X和Y的原子序数都小于两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是( )
| A. | n+11 | B. | n-5 | C. | n+3 | D. | n-6 |
1.乙醇分子中各种化学键如图所示.关于乙醇在下列反应中断键情况的说法中不正确的是( )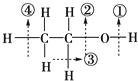

| A. | 与金属钠反应时键①断裂 | |
| B. | 与乙酸发生酯化反应时键①断裂 | |
| C. | 与浓硫酸共热到170℃时键③、④断裂 | |
| D. | 在铜催化下与氧气反应时键①、③断裂 |
 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷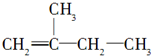 2-甲基-1丁烯
2-甲基-1丁烯 .
. .
. 分子式为C10H20,按碳的骨架分,该有机物属于ab.(填字母序号)
分子式为C10H20,按碳的骨架分,该有机物属于ab.(填字母序号)