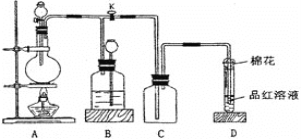
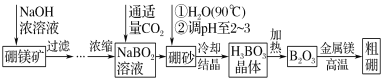
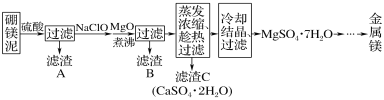
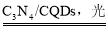题目内容
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.747 5 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为[已知:K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O]( )
A. 1∶1B. 2∶1C. 3∶1D. 2∶5
【答案】B
【解析】
第一份溶液中白色沉淀为BaSO4,质量为1.7475g,则n(BaSO4)=0.0075mol,即n(SO![]() )=0.0075mol;另一份溶液中,通过反应式:n(Fe2+):n(Cr2O72-)=6:1,n(Cr2O72-)=0.0200mol/L╳0.05L=0.001mol,求得n(Fe2+)=0.006mol,亚铁离子即由原溶液中的铁离子转化得到,根据物质不显电荷,即可求出答案。
)=0.0075mol;另一份溶液中,通过反应式:n(Fe2+):n(Cr2O72-)=6:1,n(Cr2O72-)=0.0200mol/L╳0.05L=0.001mol,求得n(Fe2+)=0.006mol,亚铁离子即由原溶液中的铁离子转化得到,根据物质不显电荷,即可求出答案。
1.7475 g白色沉淀是硫酸钡,则n(SO![]() )=1.7475 g÷233 g/mol=0.0075 mol。n(K2Cr2O7)=0.05 L×0.02000 mol/L=0.001 mol,根据方程式可知n(Fe2+)=n(K2Cr2O7)×6=0.006 mol,根据Fe守恒,n(Fe3+)=0.006mol,由电荷守恒可知n(OH-)+n(SO
)=1.7475 g÷233 g/mol=0.0075 mol。n(K2Cr2O7)=0.05 L×0.02000 mol/L=0.001 mol,根据方程式可知n(Fe2+)=n(K2Cr2O7)×6=0.006 mol,根据Fe守恒,n(Fe3+)=0.006mol,由电荷守恒可知n(OH-)+n(SO![]() )×2=n(Fe3+)×3,n(OH-)=0.006 mol×3-0.0075 mol×2=0.003 mol,得到a∶b=0.006∶0.003=2∶1,故答案为B。
)×2=n(Fe3+)×3,n(OH-)=0.006 mol×3-0.0075 mol×2=0.003 mol,得到a∶b=0.006∶0.003=2∶1,故答案为B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案