题目内容
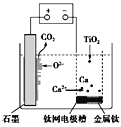
【题目】用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )

A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
【答案】C
【解析】
A. 放电时,电池正极通入空气中的O2,在碱性溶液中得电子生成OH-,A正确;
B. 放电时,正极通入空气中的CO2,会与KOH反应生成少量K2CO3,B正确;
C. 电池停止工作时,锌粉仍会与KOH溶液发生缓慢反应,C错误;
D. 充电时,电解槽阴极(放电时,Zn转化为ZnO)Zn表面的ZnO得电子,生成Zn和OH-,电极反应式为ZnO+2e-+H2O=Zn+2OH-,D正确;
故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目