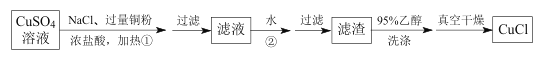
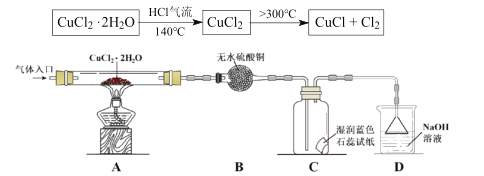
题目内容
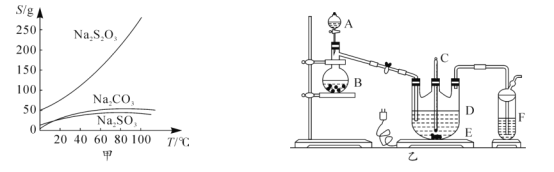
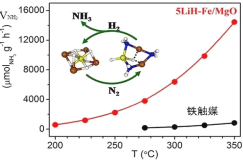
【题目】某化学课外兴趣小组为探究足量的铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。
已知:①SO2难溶于饱和亚硫酸氢钠溶液。②SO2能与酸性高锰酸钾溶液发生氧化还原反应。请回答下列问题:
(1)装置A中发生的化学反应方程式为____________;此反应表明浓硫酸具有_________(填字母)。
a. 酸性 b. 脱水性 c. 强氧化性 d. 吸水性
(2)装置D中试管口放置的棉花中浸入__________溶液,其作用是_____________。
(3)装置B的作用是贮存多余的气体,B中应放置的液体是__________(填字母)。
a. 水 b. 饱和NaHSO3溶液 c. 酸性KMnO4溶液 d. NaOH溶液
(4)实验中,取一定质量的铜片和一定体积18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是____________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是___________(填字母)。
a. 银粉 b. 铁粉 c. BaCl2溶液 d. NaHCO3溶液
【答案】Cu+2 H2SO4(浓)![]() CuSO4+SO2↑+2 H2O ac NaOH 吸收SO2气体,防止污染空气 b 浓硫酸由浓变稀,稀硫酸不再与铜反应 bd
CuSO4+SO2↑+2 H2O ac NaOH 吸收SO2气体,防止污染空气 b 浓硫酸由浓变稀,稀硫酸不再与铜反应 bd
【解析】
(1)依据实验是探究铜与浓硫酸的反应情况,反应条件加热,根据氧化还原反应的实质书写配平;
(2)依据二氧化硫是污染性气体不能排放到大气中分析;
(3)试剂不能和气体反应也不能溶于液体;
(4)根据铜与浓硫酸反应的原理分析,再计算剩余硫酸的浓度;证明有酸剩余是验证稀硫酸的存在关键是氢离子的检验。
(1)实验探究铜与浓硫酸在加热探究下发生反应,浓硫酸具有强氧化性把铜氧化为二价铜,本身被还原为二氧化硫,结合书写化学方程式的要求写出化学方程式为:Cu+2 H2SO4(浓)![]() CuSO4+SO2↑+2 H2O;
CuSO4+SO2↑+2 H2O;
此反应中硫酸中部分S化合价降低被氧化体现还原性,部分S化合价不变,生成硫酸盐,体现酸性作用,答案选ac;
(2)装置D中试管口放置的棉花中应浸一种液体,是防止装置中最后剩余的二氧化硫气体排放到大气中污染环境,所以棉团需浸能吸收二氧化硫,与二氧化硫反应的溶液,可以浸NaOH溶液;作用是吸收SO2气体,防止污染空气;
(3)二氧化硫气体是酸性氧化物,易溶于水,B中的试剂不能和二氧化硫发生反应,不能溶解二氧化硫;
a.水能溶解二氧化硫不能储存气体,b.二氧化硫通入饱和NaHSO3溶液中,降低了二氧化硫的溶解度,不反应,可以用来储存气体, c.酸性KMnO4 溶液能氧化二氧化硫为硫酸,不能储存气体, d.NaOH溶液吸收二氧化硫不能储存气体;
答案选b;
(4)①取一定质量的铜片和一定体积18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,浓硫酸随着反应进行浓度变稀后不再和铜反应,所以有剩余的酸;
②能用来证明反应结束后的烧瓶中确有余酸,实质证明氢离子的存在,选项中a.银粉不与稀硫酸反应不能证明;b.铁粉与稀硫酸反应放气体,可以证明;c.BaCl2溶液 加入后出现白色沉淀,但因为生成产物中有硫酸铜生成,也可以生成白色沉淀,故不能证明; d.Na2CO3溶液会与稀硫酸反应发出二氧化碳气体,可以证明,故答案为:bd。

 字词句段篇系列答案
字词句段篇系列答案【题目】(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
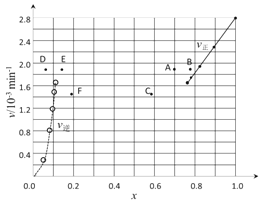
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=________min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2/span>)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)