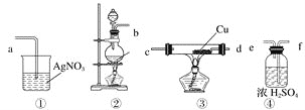
题目内容
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是______。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)______。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为______。
②完成NaClO3氧化FeCl2的离子方程式:
___![]() +___Fe2++___=___Cl+___Fe3++__
+___Fe2++___=___Cl+___Fe3++__
(3)FeCl3在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]()
![]() +H+ K2
+H+ K2
![]() +H2O
+H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是__________。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)______。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)______。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是___。
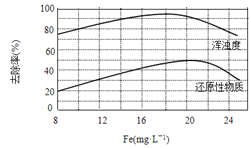
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为_____mg·L-1。
【答案】Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质 2Fe3++Fe=3Fe2+ 2 1 6 6H+ 1 6 3H2O K1>K2>K3 bd 调节溶液的pH 18~20
【解析】
(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用;钢铁设备中的Fe会与铁离子反应生成亚铁离子;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),据此溶液中氢离子的浓度,再根据pH=-lgc(H+)计算;
②根据氧化还原反应规律配平方程式;
(3)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小;根据外界条件对水解平衡的影响分析判断;
(4)由图象可知,聚合氯化铁的浓度在18~20 mgL-1时,去除率达到最佳范围。
(1)FeCl3净水的原理是Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是2Fe3++Fe=3Fe2+;
(2)若酸性FeCl2废液中电荷守恒:2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(OH-),酸性溶液中可忽略c(OH-),c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2mol/L,则该溶液的pH约为2;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3,配平后离子方程式为:![]() +6Fe2++6H+=Cl-+6Fe3++3H2O;
+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)FeCl3的分步水解程度越来越小,所以K1>K2>K3;
a.盐类水解为吸热反应,降温平衡左移,故a不符合题意;
b.加水稀释促进盐类水解,故b符合题意;
c.NH4Cl 的水解抑制上述水解,故c不符合题意;
d.NaHCO3的水解促进上述水解,故d符合题意;
故欲使平衡正向移动可采用的方法是bd;
分析离子方程式:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+可知室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是调节溶液的pH;
Fex(OH)y(3x-y)++yH+可知室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是调节溶液的pH;
(4)由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为18~20mg·L-1。

【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有少量不与酸作用的可溶性杂质,试根据实验回答:
(1)准确称取4.0g烧碱样品。
(2)将样品配成250mL待测液。
(3)用____________(填仪器名称)量取25.00mL待测液于锥形瓶中,并滴加几滴甲基橙作指示剂。
(4)用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时,两眼注视____________,直到滴定终点。达到终点的具体现象是:____________。
(5)若两次实验滴定的数据如下表:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 5.00 | 28.30 |
第三次 | 25.00 | 4.00 | 24.10 |
根据上述各数据,计算烧碱的纯度:____________
(6)下列操作中,会导致所测得的烧碱的纯度偏大的是________。
a.滴定终点时,俯视刻度
b.没有用盐酸标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚( CH3OCH3)。请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g) △H= -90.8kJ/mol
CH3OH(g) △H= -90.8kJ/mol
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol
总反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) 的△H= ;
CH3OCH3(g)+CO2(g) 的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:________(填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度e.分离出二甲醚(CH3OCH3)
(2)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度(mol·L-1) | 0.40 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小比较:![]() _________
_________![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②该反应的平衡常数的表达式为K=_____,温度升高,该反应的平衡常数K____(填“增大”、“减小”或“不变”)