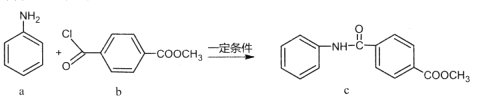
题目内容
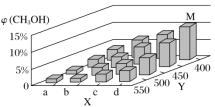
【题目】室温下,用0.1mol·L-1的盐酸滴定10mL0.1mol·L-1的Na2SO3溶液,滴定曲线如图所示(不考虑滴定过程中SO2的逸出)。下列说法错误的是( )

A.a点由水电离出的氢离子浓度大于d点由水电离出的氢离子浓度
B.0.05mol·L-1NaHSO3溶液的pH=4.25
C.c点时,c(Na+)>c(Cl-)>c(HSO![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.d点时,c(H2SO3)>c(HSO![]() )>c(SO
)>c(SO![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
【答案】D
【解析】
A.a点溶液中的溶质是NaSO3,pH=9.86,为盐类的水解,促进水的电离,d点溶液中的溶质是NaCl和H2SO3,H2SO3存在,抑制水的电离,所以a点水的电离程度大于d点水的电离程度,则a点由水电离出的氢离子浓度大于d点由水电离出的氢离子浓度,故A正确;
B.b点溶液中的溶质为NaHSO3和NaCl,根据图像,此时溶液中c(NaHSO3)=0.05mol·L-1,溶液pH=4.25,所以0.05mol·L-1NaHSO3溶液的pH=4.25,故B正确;
C.c点时,加入HCI的物质的量略大于NaSO3,c(Na+)还是最大,c(Na+)>c(Cl-)>c(HSO3-)>c(H+)>c(OH-),故C正确;
D.d点时,H2SO3和NaCl为溶液的溶质,H2SO3的两级电离都生成H+,c(H+)>c(HSO3-)>c(SO32-),故D错误;
答案为D。

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目