题目内容
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知:氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。活泼金属硫化物与酸反应产生H2S气体。
Ⅰ、制备氢化锂:选择下图中的装置制备氢化锂(有些装置可重复使用):
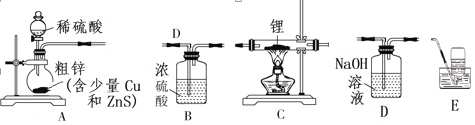
(1)装置的连接顺序(从左至右)为A→___________________________________。
(2)检查好装置的气密性,打开装置A中分液漏斗的活塞后,点燃酒精灯前需进行的实验操作是________。
Ⅱ、制备氢化铝锂
1947年,Schlesinger、Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)写出氢化锂与无水三氯化铝反应的化学方程式_________________________。
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度
(4)按下图连接好装置后,检查装置气密性的操作是:_____________________。装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是__________________。
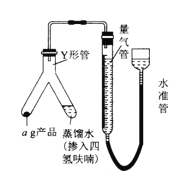
(5)在标准状况下,反应前量气管(由碱式滴定管改装而成)读数为V1 mL,反应完毕并冷却之后,量气管读数为V2 mL。该样品的纯度为_________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将_________(填“偏高”“偏低”或“无影响”)。
【答案】D→B→C→B→E 用小试管在装置E的水槽中收集气体并验纯 4LiH+AlCl3═LiAlH4+3LiCl 向量气管中加水至左右出现液面差,静置,若液面差保持稳定,则装置气密性良好 倾斜Y形管,将蒸馏水(掺入四氢呋喃)全部注入a g产品中 19(V2-V1)/448a% 偏高
【解析】
Ⅰ.(1)氢化锂遇水能够剧烈反应,因此生成的氢气需要干燥,并除去其中混有的H2S,因此需要先通过氢氧化钠溶液除去硫化氢气体,再通过浓硫酸干燥,然后在C装置中发生反应生成氢化锂,为防止外界水蒸气进入装置,后面需要接干燥装置B,最后用排水集气法收集未反应的氢气,装置的连接顺序(从左至右)为A→D→B→C→B→E;综上所述,本题答案是:D→B→C→B→E。
(2)检查好装置的气密性,点燃酒精灯前需要首先制备氢气,并检验氢气的纯度,因此进行的实验操作为:打开装置A中分液漏斗的活塞,一段时间后,用小试管在装置E的水槽中收集气体并验纯;综上所述,本题答案是:用小试管在装置E的水槽中收集气体并验纯。
Ⅱ.(3)氢化锂与无水三氯化铝按一定比例在乙醚中混合,充分反应得到LiAlH4,反应的化学方程式为:4LiH+AlCl3═LiAlH4+3LiCl;综上所述,本题答案是:4LiH+AlCl3═LiAlH4+3LiCl。
Ⅲ.(4) 按图2装配仪器,向量气管中加水至左右出现液面差,静置,若液面差保持稳定,则装置气密性良好;检查好装置气密性并装好药品,Y形管中的蒸馏水足量,启动反应时只需要倾斜Y形管,将蒸馏水(掺入四氢呋喃)全部注入ag产品中即可;综上所述,本题答案是:向量气管中加水至左右出现液面差,静置,若液面差保持稳定,则装置气密性良好;倾斜Y形管,将蒸馏水(掺入四氢呋喃)全部注入a g产品中。
(5) 氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体为氢气,LiAlH4+4H2O=LiOH+Al(OH)3+4H2↑,在标准状况下,反应前量气管读数为V1mL,反应完毕并冷却之后,量气管读数为V2mL,则生成的氢气为(V2- V1) mL,根据方程式,LiAlH4的物质的量为(V2- V1)×10-3/(4×22.4)mol,则样品的纯度为:[38×(V2- V1)×10-3/(4×22.4)]/a×100%=![]() ;如果起始读数时俯视刻度线,导致V1偏小,结果偏高;综上所述,本题答案是:.
;如果起始读数时俯视刻度线,导致V1偏小,结果偏高;综上所述,本题答案是:. ![]() ;偏高。
;偏高。