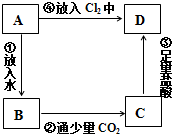
题目内容
18.下列溶液中粒子的物质的量浓度关系正确是( )| A. | 室温下pH=2的醋酸与pH=12的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(OH)>c(CH3COO-)>c(H+) | |
| B. | 含KI、KCl均为0.1mol•L-1的混合溶液10mL与20mL0.1mol.L-1AgNO3溶液混合,所得悬浊液中:c(K+)═c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| C. | 室温下,向10mL0.1mol•L-1的氨水中滴加同体积同浓度的CH3COOH的溶液,在滴加过程中:$\frac{c(N{{H}_{4}}^{+)}}{c(N{H}_{3}•{H}_{2}O)}$先增大再减小 | |
| D. | CH3COONa和CaCl2混合溶液中:c(Na+)+c(Ca2+)═c(CH3COO-)+(CH3COOH)+2c(Cl-) |
分析 A.醋酸为弱酸,混合液中醋酸过量,溶液显示酸性,则c(H+)>c(OH),根据电荷守恒可知c(CH3COO-)>c(Na+);
B.两溶液恰好反应生成氯化银、碘化银沉淀和硝酸钾,碘化银和氯化银都存在溶解平衡,且碘化银的溶解度小于氯化银,据此判断各离子浓度大小;
C.氨水的电离常数为:Kb=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$,整理可得:$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{{K}_{b}}{c(O{H}^{-})}$,然后根据滴加过程中溶液中的氢氧根离子浓度变化进行判断;
D.根据混合液中的物料守恒进行判断.
解答 解:A.室温下pH=2的醋酸与pH=12的NaOH溶液等体积混合,醋酸过量,混合液显示酸性,则c(H+)>c(OH),根据电荷守恒可知c(CH3COO-)>c(Na+),溶液中正确的离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH),故A错误;
B.含KI、KCl均为0.1mol•L-1的混合溶液10mL与20mL0.1mol.L-1AgNO3溶液混合,恰好反应生成AgCl、AgI沉淀及KNO3溶液,由于碘化银和氯化银都存在溶解平衡,且碘化银的溶解度小于氯化银,故所得悬浊液中离子浓度大小为:c(K+)=c(NO3-)>c(Ag+)>c(Cl-)>c(I-),故B正确;
C.氨水的电离常数Kb=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{{K}_{b}}{c(O{H}^{-})}$,向10mL0.1mol•L-1的氨水中滴加同体积同浓度的CH3COOH的溶液过程中,溶液中氢氧根离子浓度逐渐减小,则该比值逐渐增大,故C错误;
D.根据混合液中的物料守恒可得:c(Na+)+2c(Ca2+)═c(CH2COO-)+(CH3COOH)+c(Cl-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,C为易错点,注意利用氨水的电离平衡常数的变形公式进行分析.

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案| A. | 有使湿润的pH试纸变蓝的气体产生 | |
| B. | 滴有水滴的玻璃片冻结在烧杯底部 | |
| C. | 盛有饱和硝酸钾溶液的试管置于反应混合物内,拿出后发现溶液浑浊 | |
| D. | 烧杯外壁有水珠凝结 |
| A.Cl2与CH4取代反应后的产物: | 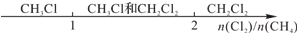 |
| B.向烧碱液中通入SO2后的产物: |  |
| C.铁与稀硝酸反应: | 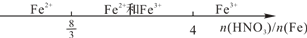 |
| D.向AlCl3溶液中滴加NaOH溶液,铝元素的存在形式: |  |
| A. | A | B. | B | C. | C | D. | D |
| A. |  4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 | |
| B. | 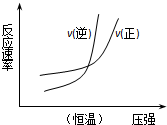 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 | |
| C. | 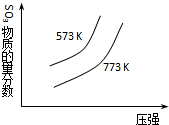 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 | |
| D. | 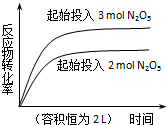 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 |
| A. | M具有很高的熔沸点 | |
| B. | M容易汽化,可用作制冷材料 | |
| C. | M和干冰互为同素异形体 | |
| D. | M是由C原子和O原子按1:2的比例所组成的平面网状的晶体 |
| A. | CO2 | B. | CaCl2 | C. | C2H6 | D. | NaOH |
| A. | c(H2SO3)>c(SO32-) | |
| B. | 溶液中HSO3-电离程度大于水解程度 | |
| C. | 水电离出c(H+)=10-5mol•L-1 | |
| D. | c(Na+ )+c(H+)=c(HSO3-)+c(OH-)+c(SO32-) |