题目内容
14.物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,B,C,D是含有A元素的三种不同化合物,A、B、C、D按如图关系进行转化: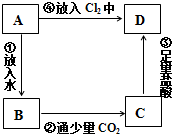
(1)写出化学式:ANa BNaOHCNa2CO3 DNaCl
(2)写出①②的离子方程式.①2Na+2H2O=2Na++2OH-+H2↑;②2OH-+CO2=CO3+2-+H2O.
(3)写出③④的化学方程式:③Na2CO3+2HCl=2NaCl+CO2↑+H2O; ④2Na+Cl2 $\frac{\underline{\;点燃\;}}{\;}$2NaCl.
分析 物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,则A为Na,B,C,D是含有A元素的三种不同化合物,为钠的化合物,钠与水反应生成B为NaOH,氢氧化钠与少量的二氧化碳反应生成C为Na2CO3,碳酸钠与足量的盐酸反应生成D,且钠与氯气反应也生成D,故D为NaCl.
解答 解:物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,则A为Na,B,C,D是含有A元素的三种不同化合物,为钠的化合物,钠与水反应生成B为NaOH,氢氧化钠与少量的二氧化碳反应生成C为Na2CO3,碳酸钠与足量的盐酸反应生成D,且钠与氯气反应也生成D,故D为NaCl.
(1)由上述分析可知,A为Na,B为NaOH,C为,D为NaCl,
故答案为:Na;NaOH;Na2CO3;NaCl;
(2)反应①是钠与水反应生成氢氧化钠与氢气,反应离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;
反应②是氢氧化钠与少量的二氧化碳反应生成碳酸钠与水,反应离子方程式为:2OH-+CO2=CO3+2-+H2O,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2OH-+CO2=CO3+2-+H2O;
(3)反应③是碳酸钠与足量的盐酸反应生成氯化钠、二氧化碳与水,反应方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
反应④是钠与氯气反应生成氯化钠,反应方程式为2Na+Cl2 $\frac{\underline{\;点燃\;}}{\;}$2NaCl,
故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;2Na+Cl2 $\frac{\underline{\;点燃\;}}{\;}$2NaCl.
点评 本题考查无机物推断,涉及钠元素单质及其化合物的性质及相互转化,难度不大,注意基础知识的掌握.

| A. | 7.8 g苯含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA | |
| C. | 1.6 g CH4含有共用电子对的数目为0.5NA | |
| D. | 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA |
| A. | 饱和Na2CO3溶液和乙酸乙酯 | B. | 甘油和水 | ||
| C. | 溴乙烷和水 | D. | 苯和水 |
①NaOH ②AgNO3 ③Na2CO3 ④FeCl2.
| A. | ②④ | B. | ①②③ | C. | ①③ | D. | ①②③④ |
| A. | 达到化学平衡时,υ正(NH3)=υ逆(H2O) | |
| B. | 达到化学平衡时,4υ (O2)=5υ (NO) | |
| C. | 若单位时间内生成x mol NO的同时,也消耗x mol NH3 | |
| D. | 若单位时间内生成4 mol NO的同时,也生成4 mol NH3 |
| A. | 甲烷的电子式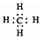 | B. | 氟化氢的电子式 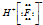 | C. | N2的电子式  | D. | Na2S的电子式  |
| A. | 室温下pH=2的醋酸与pH=12的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(OH)>c(CH3COO-)>c(H+) | |
| B. | 含KI、KCl均为0.1mol•L-1的混合溶液10mL与20mL0.1mol.L-1AgNO3溶液混合,所得悬浊液中:c(K+)═c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| C. | 室温下,向10mL0.1mol•L-1的氨水中滴加同体积同浓度的CH3COOH的溶液,在滴加过程中:$\frac{c(N{{H}_{4}}^{+)}}{c(N{H}_{3}•{H}_{2}O)}$先增大再减小 | |
| D. | CH3COONa和CaCl2混合溶液中:c(Na+)+c(Ca2+)═c(CH3COO-)+(CH3COOH)+2c(Cl-) |
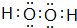 .
.