题目内容
6.某些化学知识用数轴表示能体现出形象直观、简明易记的特点.下列用数轴表示不合理的是( )| A.Cl2与CH4取代反应后的产物: | 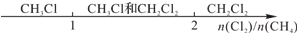 |
| B.向烧碱液中通入SO2后的产物: |  |
| C.铁与稀硝酸反应: | 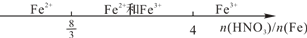 |
| D.向AlCl3溶液中滴加NaOH溶液,铝元素的存在形式: |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯气和甲烷发生取代反应是连锁反应四种取代产物都会生成;
B.烧碱溶液中通入少量二氧化硫反应生成亚硫酸钠,通入过量二氧化硫生成亚硫酸氢钠;
C.少量铁和稀硝酸反应生成三价铁离子,过量的铁和硝酸反应最后生成亚铁离子;
D.氯化铝溶液中滴入氢氧化钠开始生成氢氧化铝沉淀,到全部生成氢氧化铝后,继续滴加氢氧化钠溶液,氢氧化铝溶解生成偏铝酸钠.
解答 解:A.氯气和甲烷发生取代反应是连锁反应四种取代产物都会生成,故A错误;
B.烧碱溶液中通入少量二氧化硫反应生成亚硫酸钠,n(NaOH):n(SO2)=2:1反应生成亚硫酸钠,通入过量二氧化硫生成亚硫酸氢钠,n(NaOH):n(SO2)=1:1,反应生成亚硫酸氢钠,在2:1~1:1范围内生成亚硫酸钠和亚硫酸氢钠,故B正确;
C.少反应的化学方程式:4HNO3(稀足)+Fe═Fe(NO3)3+NO↑+2H2O,3HNO3+8Fe═3Fe(NO3)2+2NO↑+4H2O,量铁和稀硝酸反应生成三价铁离子,n(HNO3):n(Fe)=4:1,;过量的铁和硝酸反应最后生成亚铁离子,n(HNO3):n(Fe)=8:3;,在4:1~8:3范围内生成硝酸亚铁和硝酸铁,数轴变化符合,故C正确;
D.OH-与Al3+的物质的量之比为3:1时,铝元素都以Al(OH)3的形式存在,即OH-与Al3+的物质的量之比为≤3时铝元素都以Al(OH)3和Al3+的形式存在,OH-与Al3+的物质的量之比为4:1时,铝元素都以AlO2-的形式存在,即OH-与Al3+的物质的量之比为≥4时铝元素都以AlO2-的形式存在,故D正确;
故选A.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,难度较大,注意把握物质的性质以及反应类型的把握.

①NaOH ②AgNO3 ③Na2CO3 ④FeCl2.
| A. | ②④ | B. | ①②③ | C. | ①③ | D. | ①②③④ |
| A. | 甲烷的电子式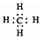 | B. | 氟化氢的电子式 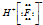 | C. | N2的电子式  | D. | Na2S的电子式  |
| A. | 已知C(石墨,s)=C(金刚石,s)△H>O,则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)═2H20(1)△H=-571.6kJ•mol-1,则氢气的燃烧热为-285.8kJ•mol-1 | |
| C. | 含20.0 gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该条件下稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═H3COOHNa(aq)+H2O(l)H=-57.4kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1:2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 |
| A. | 室温下pH=2的醋酸与pH=12的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(OH)>c(CH3COO-)>c(H+) | |
| B. | 含KI、KCl均为0.1mol•L-1的混合溶液10mL与20mL0.1mol.L-1AgNO3溶液混合,所得悬浊液中:c(K+)═c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| C. | 室温下,向10mL0.1mol•L-1的氨水中滴加同体积同浓度的CH3COOH的溶液,在滴加过程中:$\frac{c(N{{H}_{4}}^{+)}}{c(N{H}_{3}•{H}_{2}O)}$先增大再减小 | |
| D. | CH3COONa和CaCl2混合溶液中:c(Na+)+c(Ca2+)═c(CH3COO-)+(CH3COOH)+2c(Cl-) |
| A. | 中子数为33 | B. | 电子数为33 | C. | 质量数为60 | D. | 质子数为27 |
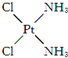 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为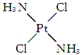 ,无抗癌作用.顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:顺式结构,顺铂易溶于水,因为它是极性分子,易溶于极性溶剂.
,无抗癌作用.顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:顺式结构,顺铂易溶于水,因为它是极性分子,易溶于极性溶剂.